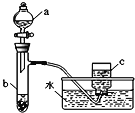
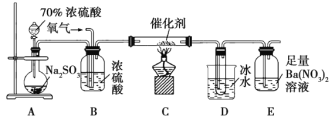
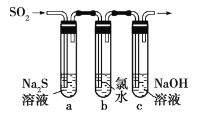
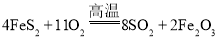题目内容
【题目】工业制HNO3的过程中排放的NO2和NO常用NaOH溶液吸收,反应的化学方程式为NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O,NO不能被NaOH溶液吸收。若同温同压下NO2与NO的体积之比如下,其中不能被NaOH溶液完全吸收的是( )
A.1:1B.1:3C.2:1D.3:1
【答案】B
【解析】
A. 根据![]() 可知,当NO2与NO的体积之比为1:1时,恰好被完全吸收,故A项不符合题意;
可知,当NO2与NO的体积之比为1:1时,恰好被完全吸收,故A项不符合题意;
B. 当NO2与NO的体积之比为1:3时,一氧化氮过量,多余的一氧化氮不能被氢氧化钠溶液吸收,故B项符合题意;
C、D. 当NO2与NO的体积之比为2:1或3:1时,反应后二氧化氮有剩余,由![]() 可知,多余的二氧化氮可以直接被氢氧化钠溶液完全吸收,故C、D项不符合题意;
可知,多余的二氧化氮可以直接被氢氧化钠溶液完全吸收,故C、D项不符合题意;
故答案为B。

【题目】研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:

已知:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是_____________________。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?__________(“是”或“否”),理由是____________________________________________________。
(3)对比试管a、b、c的实验现象,可知pH增大![]() _____(选填“增大”,“减小”,“不变”);
_____(选填“增大”,“减小”,“不变”);
(4)分析如图试管c继续滴加KI溶液、过量稀H2SO4的实验现象,说明+6价铬盐氧化性强弱为Cr2O72-__________CrO42-(填“大于”,“小于”,“不确定”);写出此过程中氧化还原反应的离子方程式_________。
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
实验 | ⅰ | ⅱ | ⅲ | ⅳ |
是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
①实验ⅱ中Cr2O72-放电的电极反应式是________________。
②实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因_______________。