题目内容
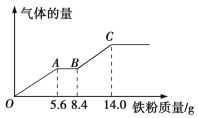
【题目】现有某稀硫酸和稀硝酸的混合溶液200 mL,将其平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g铜粉;向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化关系如图所示(假设硝酸的还原产物为NO气体)。下列分析或结果正确的是
A. 原混合溶液中NO3-的物质的量为0.2 mol
B. OA段产生的是氢气
C. BC段产生NO
D. 原混合溶液中H2SO4的浓度为1.25mol/L
【答案】A
【解析】
铁粉既能和稀硝酸反应也能和稀硫酸反应,硝酸的氧化性比硫酸强,所以硝酸先发生反应。由图象可知在铁过量时, OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑。据此解答。
A.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,每一份溶液中n(NO3-)=n(Fe),所以原混合酸中n(HNO3)=2n(Fe)=2×![]() ,A正确;
,A正确;
B.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,可见OA产生的气体是NO,不是氢气,B错误;
C.在BC段发生反应为:Fe+2H+=Fe2++H2↑,可见BC段产生的气体是H2,C错误;
D.根据图像可知:当加入Fe粉14g时,气体飞物质的量不再增加,此时溶液中溶质为FeSO4,此时反应消耗铁的物质的量n(Fe)=![]() =0.25mol,根据元素原子守恒可知n(H2SO4)=n(FeSO4)=n(Fe)=0.25mol,故硫酸的浓度是c(H2SO4)=
=0.25mol,根据元素原子守恒可知n(H2SO4)=n(FeSO4)=n(Fe)=0.25mol,故硫酸的浓度是c(H2SO4)=![]() =2.5mol/L,由于溶液有均一性,溶液的浓度与体积无关,所以原混合溶液中H2SO4的浓度为2.5mol/L,D错误;
=2.5mol/L,由于溶液有均一性,溶液的浓度与体积无关,所以原混合溶液中H2SO4的浓度为2.5mol/L,D错误;
故合理选项是D。

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】(13分)用辉铜矿(主要成分为 Cu2S,含少量Fe2O3、SiO2,等杂质)制备难溶于水的碱式碳酸铜的流程如下:

(1)下列措施是为了加快浸取速率,其中无法达到目的的是____(填字母)。
A.延长浸取时间 | B.将辉铜矿粉碎 |
C.充分搅拌 | D.适当增加硫酸浓度 |
(2)滤渣I巾的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:_______。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是___________。
(4)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A可以是_______(填化学式);“赶氨”时,最适宜的操作方法是________。
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为_______。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。