题目内容
15.某化学兴趣小组用图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
(1)写出该实验中生成乙烯使溴水褪色的化学方程式:CH2=CH2+Br2→CH2Br-CH2Br.
(2)甲同学认为:考虑到该混合液反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是bc
a.乙烯与溴水易发生取代反应
b.使溴水褪色的反应,未必是加成反应
c.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后认为试管中液体分层,油状液体在下层的现象可证明反应中有乙烯生成,请你写出下层该物质与NaOH水溶液加热反应的化学方程式CH2Br-CH2Br+2NaOH$→_{水}^{△}$ CH2OH-CH2OH+2NaBr.
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加如图2装置,以除去乙烯中的杂质气体,则A中的试剂应为NaOH溶液B中的试剂应为品红溶液,气体经过B无现象即可证明是较为纯净的乙烯.
(5)若证明乙烯和溴发生的是加成反应,而不是取代反应,可将产生的气体经净化后通入溴的四氯化碳溶液,再接入如图3装置,向 D中加入硝酸银溶液,若无淡黄色沉淀产生,则能证明.
分析 (1)乙烯与溴发生加成反应生成1,2-二溴乙烷;
(2)浓H2SO4具有强氧化性,能将乙醇氧化成,根据SO2具有还原性,也能与溴水反应使溴水褪色,据此即可解答;
(3)1,2-二溴乙烷密度大于水,1,2-二溴乙烷在碱性条件下水解生成乙醇;
(4)在Ⅰ和Ⅱ之间增加图2装置,A装置是为了除去SO2和CO2,B装置是为了检验SO2是否除尽;
(5)若发生取代反应则会生成HBr,用硝酸银溶液检验会生成浅黄色沉淀.
解答 解:(1)乙烯使溴水褪色,乙烯与溴发生加成反应生成1,2-二溴乙烷,其反应的方程式为:CH2=CH2+Br2→CH2Br-CH2Br;
故答案为:CH2=CH2+Br2→CH2Br-CH2Br;
(2)浓H2SO4具有强氧化性,将乙醇氧化成碳,并且可以进一步反应,C+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,SO2具有还原性,可以与Br2反应,SO2+Br2+2H2O=2HBr+H2SO4,所以bc正确,
故答案为:bc;
(3)溴水中的溴与乙烯发生加成反应生成 CH2BrCH2Br,1,2-二溴乙烷密度大于水,在试管底部,1,2-二溴乙烷在碱性条件下水解生成乙醇,其水解方程式为:CH2Br-CH2Br+2NaOH$→_{水}^{△}$ CH2OH-CH2OH+2NaBr;
故答案为:CH2Br-CH2Br+2NaOH$→_{水}^{△}$ CH2OH-CH2OH+2NaBr;
(4)在Ⅰ和Ⅱ之间增加图2装置,A装置是为了除去SO2和CO2,可用NaOH溶液吸收;B装置是为了检验SO2是否除尽,可用品红溶液,
故答案为:NaOH溶液;品红溶液;
(5)若发生取代反应则会生成HBr,可将产生的气体经净化后通入溴的四氯化碳溶液,再接入如图3装置,向 D中加入硝酸银溶液,若没有生成浅黄色沉淀说明没有HBr,即没有发生取代反应;
故答案为:硝酸银.
点评 本题考查了实验室制取1,2-二溴乙烷方法、乙烯的化学性质,题目难度中等,明确实验原理是解答本题的关键,根据浓硫酸、乙烯的性质来分析解答.

 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反
应:CO (g)+H2O(g)?CO2(g)+H2(g),△H<0
800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=l.0.
| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
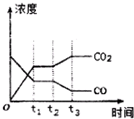
②如图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是降低温度或降低H2浓度或增大H2O(g)浓度.(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:
CO(g)+l/2O2(g)?CO2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请在表中的空格处填写“>““<”或“=“.
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验.可选用试剂:①KSCN溶液 ②NaOH溶液 ③酸性KMnO4溶液 ④K3[Fe(CN)6]溶液.
(1)请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 溶液变(血)红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴③或④(填序号)溶液,振荡 | 紫红色褪去或产生蓝色沉淀 | 存在Fe2+ |
Ⅱ.AgNO3的热稳定性
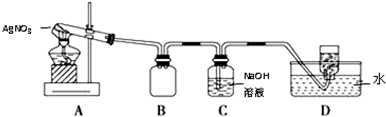
用如图所示的实验装置A加热固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束以后,试管中残留固体为黑色.
(2)装置B的作用是安全瓶(或防止倒吸).
(3)经小组讨论并验证该无色气体为O2,其操作方法是用玻璃片盖住集气瓶口并取出,正放在桌面上,然后将带火星的木条伸入集气瓶内,若木条复燃则证明是O2.
(4)[查阅资料】①Ag2O和粉末的Ag均为黑色;②Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是①Ag②Ag2O③Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验:
| 实验编号 | 操 作 | 现 象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
【实验拓展】另取2.0g AgNO3样品充分受热分解,共收集到标准状况下气体的体积为336mL,则样品中AgNO3的百分含量为85%.
| A. | 若R(OH)n为强碱,则W(OH)n+1也为强碱 | |
| B. | 若最高氧化物的水化物HnXOm为强酸,则Y是活泼非金属元素 | |
| C. | 若Y的最低化合价为-2,则Z的最高正化合价为+6 | |
| D. | 若X的最高正化合价为+5,则五种元素都是非金属元素 |
甘氨酸(H2N-CH2COOH),丙氨酸(
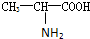 ),苯丙氨酸(
),苯丙氨酸(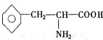 )
)谷氨酸(
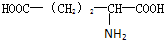 ),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是( )
),则该多肽中所含肽键的数目以及水解后得到的谷氨酸和苯丙氨酸的数目分别是( )| A. | 10,4,3 | B. | 10,3,4 | C. | 9,4,3 | D. | 9,3,4 |
| A. | 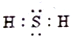 | B. |  | C. |  | D. |  |
| A. | 亚硫酸钠溶液与双氧水混合:SO32-+2H2O2=SO42-+2H2O+O2↑ | |
| B. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O=Fe(OH)2↓+2HClO | |
| C. | NH4HCO3溶液与足量NaOH溶液反应:NH4++OH-=NH3↑+H2O | |
| D. | 碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A. | 甲的金属性比乙强 | B. | 乙的化合价为+1价 | ||
| C. | 丙一定为金属元素 | D. | 丁一定是金属元素 |
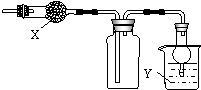 如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )