题目内容
5.气态中性原子失去一个电子转化为气态正离子所需要的最低能量叫做第一电离能(I1),气态正离子继续失去电子所需最低能量依次称为第二电离能(I2)、第三电离能(I3)…下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据.下列说法正确的是( )| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A. | 甲的金属性比乙强 | B. | 乙的化合价为+1价 | ||
| C. | 丙一定为金属元素 | D. | 丁一定是金属元素 |
分析 由题意知,电离能越小,失电子越容易,该元素金属性越强,甲、乙、丙、丁为第三周期元素,甲元素的第一电离能远远小于第二电离能,说明A元素最外层有1个电子,失去1个电子时达到稳定结构,所以甲为Na元素;乙元素的第二电离能远远小于第三电离能,则B元素最外层有2个电子,失去两个电子后达到稳定结构,所以乙为Mg元素;丙、丁元素的第一电离、第二电离能、第三电离能相差不大,说明丙元素最外层大于3个电子,丙、丁一定为非金属元素;结合结构和性质分析解答.
解答 解:A.甲为钠,第一电离能最小,所以金属性最强,故A正确;
B.乙元素的第二电离能远远小于第三电离能,则乙元素最外层有2个电子,失去两个电子后达到稳定结构,所以乙为Mg元素,化合价为+2价,故B错误;
C.丙元素的第一电离、第二电离能、第三电离能相差不大,说明丙元素最外层大于3个电子,丙、丁一定为非金属,故C错误;
D.元素的第一电离、第二电离能、第三电离能相差不大,说明丙元素最外层大于3个电子,丙、丁一定为非金属,故D错误;
故选:A.
点评 本题考查了电离能与元素的金属性的关系,明确电离能的含义是解题关键,题目难度不大,注意对数据的分析.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
13.下列叙述正确的是( )
| A. | 烷烃分子中,碳原子都以碳碳单键结合,其余的价键均与氢原子结合,这一系列化合物的分子通式为C2nH2n+2 | |
| B. | 分子组成相差一个或若干个CH2原子团的物质,互称为同系物 | |
| C. | 烷烃分子中,相邻的三个碳原子有可能在同一条直线上 | |
| D. | 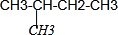 CH4、CH3CH2CH3互为同系物 CH4、CH3CH2CH3互为同系物 |
14.下列烃中可能存在同分异构体的是( )
| A. | 乙烷 | B. | 丙烷 | C. | 丁烷 | D. | 丙烯 |
15.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
(1)在这些元素中,化学性质最不活泼的元素名称是氖,元素原子半径最小的是H,⑧号元素的离子结构示意图为 .
.
(2)在上述元素的最高价氧化物对应水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH,既能与强酸反应,又能与强碱反应的化合物的化学式是Al(OH)3.
(3)⑧、⑨号元素的氢化物中还原性较强的是H2S(填化学式).
(4)⑦的最高价氧化物与⑤的最高价氧化物对应的水化物反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O
(5)写出能说明⑨的非金属性比⑧强的一个实验事实氯气与硫化钠反应生成氯化钠和硫单质.
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
 .
.(2)在上述元素的最高价氧化物对应水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH,既能与强酸反应,又能与强碱反应的化合物的化学式是Al(OH)3.
(3)⑧、⑨号元素的氢化物中还原性较强的是H2S(填化学式).
(4)⑦的最高价氧化物与⑤的最高价氧化物对应的水化物反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O
(5)写出能说明⑨的非金属性比⑧强的一个实验事实氯气与硫化钠反应生成氯化钠和硫单质.
 .
.
