题目内容
4.下列离子方程式书写正确的是( )| A. | 亚硫酸钠溶液与双氧水混合:SO32-+2H2O2=SO42-+2H2O+O2↑ | |
| B. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O=Fe(OH)2↓+2HClO | |
| C. | NH4HCO3溶液与足量NaOH溶液反应:NH4++OH-=NH3↑+H2O | |
| D. | 碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
分析 A.亚硫酸钠溶液与双氧水反应生成硫酸钠和水,不会生成氧气;
B.次氯酸具有强氧化性,反应生成氢氧化铁沉淀;
C.氢氧化钠足量,铵根离子和碳酸氢根离子都参与反应,漏掉了碳酸氢根离子与氢氧根离子的反应;
D.氢氧化钠少量,离子方程式按照氢氧化钠的化学式组成书写,反应生成碳酸钙沉淀、碳酸氢钠和水.
解答 解:A.离子方程式中的双氧水化合价从-1变化为0价,亚硫酸根离子化合价从+4升高为+6价,化合价都升高,所以不符合氧化还原反应规律,正确的离子方程式为:SO32-+H2O2=SO42-+H2O,故A错误;
B.NaClO溶液与FeCl2溶液混合,亚铁离子被氧化成铁离子,正确的离子方程式为:2Fe2++5ClO-+5H2O=2Fe(OH)3↓+4HClO+Cl-,故B错误;
C.NH4HCO3溶液与足量NaOH溶液反应生成碳酸钠、氨气和水,正确的离子方程式为:2OH-+NH4++HCO3-=CO32-+NH3↑+2H2O,故C错误;
D.碳酸氢钙溶液中加入少量的氢氧化钠溶液,碳酸氢根离子部分参与反应,反应的离子方程式为:Ca2++HCO3-+OH-=CaCO3↓+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
14.下列各组离子在强碱性溶液里能大量共存的是( )
| A. | Na+、K+、Mg2+、SO42- | B. | Ba2+、Na+、NO3-、HCO3- | ||
| C. | Na+、K+、S2-、CO32- | D. | Na+、S2- ClO-、Cl- |
12.下列各组微粒具有相同的质子数和电子数的是( )
| A. | OH-、H2O、F- | B. | H3O+、NH4+、Cl- | C. | HF、Ne、H2O | D. | NH3、NH4+、F- |
9.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别可能是( )
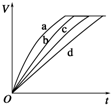
| 组别 | c(HCl)(mol•L-1) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 50 | 粉末状 |

| A. | 1-2-4-3 | B. | 1-2-3-4 | C. | 3-4-2-1 | D. | 4-3-2-1 |
13.下列叙述正确的是( )
| A. | 烷烃分子中,碳原子都以碳碳单键结合,其余的价键均与氢原子结合,这一系列化合物的分子通式为C2nH2n+2 | |
| B. | 分子组成相差一个或若干个CH2原子团的物质,互称为同系物 | |
| C. | 烷烃分子中,相邻的三个碳原子有可能在同一条直线上 | |
| D. | 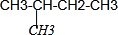 CH4、CH3CH2CH3互为同系物 CH4、CH3CH2CH3互为同系物 |
14.下列烃中可能存在同分异构体的是( )
| A. | 乙烷 | B. | 丙烷 | C. | 丁烷 | D. | 丙烯 |
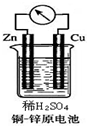 如图所示的铜-锌原电池中,理论上应观察到的现象是:
如图所示的铜-锌原电池中,理论上应观察到的现象是: .
.