题目内容
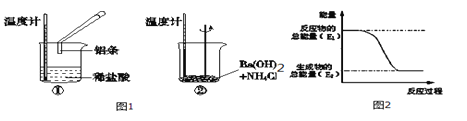
【题目】Ⅰ.某课外兴趣小组对H2O2的分解速率做了科学探究,采集的数据见下表:
用10mL H2O2制取150mLO2所需的时间(秒)
反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 260 | 480 | 540 | 720 |
MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
(1)该小组在设计方案时。考虑了浓度、 、 等因素对过氧化氢分解速率的影响。
(2)从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
。
Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如右下图所示(A,B,C均为气体,且A气体有颜色)。
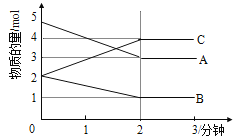
(3)该反应的的化学方程式为 。
(4)反应开始至2分钟时,B的平均反应速率为 。
(5)能说明该反应已达到平衡状态的是
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
【答案】Ⅰ.(1)催化剂、温度(2)一般加入催化剂,反应速率加快(或升高温度反应速率加快,降低温度反应速率减慢;增加反应物浓度,反应速率加快,减小反应物浓度,反应速率减慢)
Ⅱ.(3)2A + B ![]() 2C(4)0.1mol.(L.min)-1(5) cd
2C(4)0.1mol.(L.min)-1(5) cd
【解析】
试题分析:Ⅰ.(1)从表中数据看,浓度相同时,无催化剂不加热,几乎不反应,而无催化剂加热,需要260秒,说明升高温度,反应速率加快;使用催化剂加热,需要10秒,说明使用催化剂能大大提高反应速率.该研究小组在设计方案时.考虑了浓度、催化剂、温度等因素对过氧化氢分解速率的影响;(2)对比不同条件,反应所需时间的多少,可知浓度、温度、催化剂对反应速率的影响,分别为:一般加入催化剂、反应速率加快(或,升高温度反应速率加快,降低温度反应速率减慢;增加反应物浓度,反应速率加快,减小反应物浓度,反应速率减慢);
Ⅱ(3)在0-3分钟内,A减少了2mol,B减少了1mol,C增加了2mol,则该反应的的化学方程式为2A + B ![]() 2C;
2C;
(4)反应开始至2分钟时,B减少了1mol,则B的平均反应速率为1÷5÷2=0.1mol·(L·min)-1;
(5)a.反应中任意时刻都有v(A)= 2v(B),a错误;b.容器内各物质的物质的量相等,不能说明达到平衡状态,b错误;c.v逆(A)=v正(C),说明正逆速率相等,达到平衡状态,c正确;d.A气体有颜色,容器内气体的颜色保持不变,说明A的浓度不再改变,说明达到平衡状态,d正确;答案选cd。