题目内容
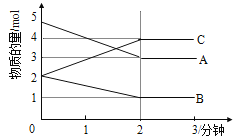
【题目】一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2(g)+3H2(g)![]() 2NH3(g)。2min时测得剩余N2为1mol,此时表示的化学反应速率正确的是( )
2NH3(g)。2min时测得剩余N2为1mol,此时表示的化学反应速率正确的是( )
A.v(N2)=0.25mol·Lˉ1·minˉ1 B.v(H2)=0.5mol·Lˉ1·minˉ1
C.v(NH3)=1mol·Lˉ1·minˉ1 D.v(NH3)=0.25mol·Lˉ1·minˉ1
【答案】A
【解析】
试题分析:在一定条件下,向2L密闭容器中加入2mol N2和10molH2,发生反应N2(g)+3H2(g)2NH3(g),2min末时,测得剩余氮气为1mol,故2min内,以 N2表示的反应速率v(N2)=![]() =0.25 mol/(Lmin),根据速率之比等于化学计量数之比可知:v(H2)=3v(N2)=3×0.25 mol/(Lmin)=0.75 mol/(Lmin),v(NH3)=2v(N2)=2×0.25 mol/(Lmin)=0.5mol/(Lmin),
=0.25 mol/(Lmin),根据速率之比等于化学计量数之比可知:v(H2)=3v(N2)=3×0.25 mol/(Lmin)=0.75 mol/(Lmin),v(NH3)=2v(N2)=2×0.25 mol/(Lmin)=0.5mol/(Lmin),
故选A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目