题目内容
【题目】2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛。
(1)利用Fe 2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe 3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4 H+ =4Fe3+ +2H2O,则另一反应的离子方程式为_________________;
(2)草酸亚铁为黄色固体,作为一种化工原料, 可广泛用于涂料、染料、陶瓷、玻璃器皿等的着色剂以及新型电池材料、感光材料的生产。合成草酸亚铁的流程如下:
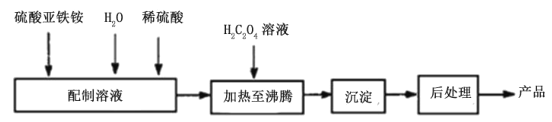
①配制(NH4) 2Fe(SO4)2溶液时,需加入少量稀硫酸,目的是___________________。
②得到的草酸亚铁沉淀需充分洗涤,洗涤操作的具体方法为_________________________________,检验是否洗涤干净的方法是___________________________。
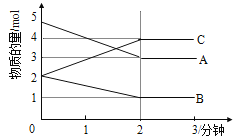
(3)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行加热分解,结果如下图(TG%表示残留固体质量占原样品总质量的百分数)。
① 则A→B发生反应的化学方程式为:__________________________________。
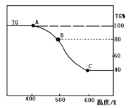
②已知 B→C过程中有等物质的量的两种气态氧化物生成,写出B→C的化学方程式____________;
(4)某草酸亚铁样品中含有少量草酸铵。为了测定不纯产品中草酸根的含量,某同学做了如下分析实验:
Ⅰ.准确称量m g 样品,溶于少量2mol/L 硫酸中并用 100mL 容量瓶定容。
Ⅱ.取上述溶液20mL,用c mol/L高锰酸钾标准溶液滴定,溶液变为淡紫色,消耗高锰酸钾溶液的体积为V 1 mL。
Ⅲ.向上述溶液中加入足量 Zn 粉,使溶液中的 Fe3+恰好全部还原为 Fe2+。
Ⅳ.过滤,洗涤剩余的锌粉和锥形瓶,洗涤液并入滤液
Ⅴ.用c mol/L KMnO4溶液滴定该滤液至溶液出现淡紫色,消耗KMnO4溶液的体积V 2 mL。
已知:2MnO4- +5H2C2O 4+6H+=2Mn2+ +10CO2+8H2O
MnO4- +8H++5Fe2+ =5Fe3+ + Mn2+ +4H2O
回答下列问题:
①若省略步骤Ⅳ,则测定的草酸根离子含量(填―偏大‖、―偏小‖或―不变‖)。
②mg样品中草酸根离子的物质的量为(用 c,V1,V2的式子表示,不必化简)。
【答案】(1)2 Fe3++SO2+2H2O=2 Fe2+ +SO42- +4H+;
(2)①抑制Fe2+和NH4+离子水解; ②沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复 2-3 次;取少量最后一次的洗涤滤液于试管中,向其中滴加盐酸酸化的 BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净。
(3)①FeC2O4·2H2O![]() FeC2O4 +2H2O(2分)②FeC2O4
FeC2O4 +2H2O(2分)②FeC2O4![]() FeO+CO2↑+CO↑;
FeO+CO2↑+CO↑;
(4)①偏大②(cV1– cV2)×10 -3 ×5/2×5mol
【解析】
试题分析:(1)常温下将SO2转化为SO42-而实现SO2的处理.含SO2的废气通入含Fe2+、Fe3+的溶液时其中一个反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为三价铁离子氧化二氧化硫到硫酸根离子,反应的离子方程式为:2Fe3++SO2+2H20=2Fe2++SO42-+4H+;
(2)①因 NH4+和Fe2+水解使溶液显酸性,则配制(NH4)2Fe(SO4)2溶液时,需加入少量稀硫酸,其目的是抑制Fe2+和NH4+离子水解。②洗涤沉淀的方法是:沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复 2-3 次;因溶液中含有 SO42-,能与Ba2+生成不溶于酸的 BaSO4沉淀,故检验沉淀是否洗净的方法是:取少量最后一次的洗涤滤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净。
(3)①由图可知,加热生成 B时,剩余物体为 80%,损失20%,FeC2O4·2H2O中结晶水的质量分数为 36/180×100%=20%,故 A→B 发生的反应是FeC2O4·2H2O 加热失去结晶水,反应的化学方程式为 FeC2O4·2H2O ![]() FeC2O4+2H2O;②已知 B→C 过程中有等物质的量的两种气态氧化物生成,根据原子守恒可知两种氧化物是CO和 CO2,由图可知,加热生成 C 时,分解完全,假定草酸盐铁晶体为 180g,其物质的量为 1mol,则C固体的质量为 180g×40%=72g,铁元素的质量为 56g,故应含氧元素的质量为 72g-56g=16g,氧原子的物质的量为1mol ,所以固 体 C为 FeO, B→C 的化 学 方 程 式 为FeC2O4
FeC2O4+2H2O;②已知 B→C 过程中有等物质的量的两种气态氧化物生成,根据原子守恒可知两种氧化物是CO和 CO2,由图可知,加热生成 C 时,分解完全,假定草酸盐铁晶体为 180g,其物质的量为 1mol,则C固体的质量为 180g×40%=72g,铁元素的质量为 56g,故应含氧元素的质量为 72g-56g=16g,氧原子的物质的量为1mol ,所以固 体 C为 FeO, B→C 的化 学 方 程 式 为FeC2O4 ![]() FeO+CO2↑+CO↑。
FeO+CO2↑+CO↑。
(4)①若省略步骤Ⅳ,则与Fe2+反应的高锰酸钾减少,因此与草酸根反应的高锰酸钾增加,则测定的草酸根离子的含量偏大;②与 Fe2+反应的高锰酸钾的物质的量为0.001cV2mol,则与草酸根反应的高锰酸钾的物质的量为(cV1-cV2)×10-3mol,根据方程式可知草酸根的物质的量为(cV1-cV2)×10-3×5/2mol,则 m g 样品中草酸根离子的物质的量为(cV1- cV2)×10-3×5/2×5mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案