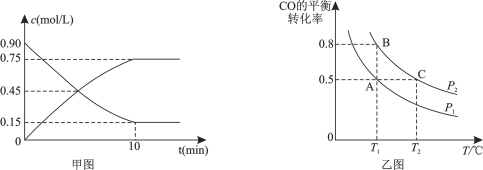
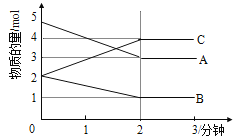
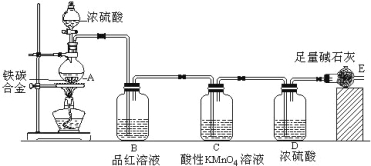
题目内容
【题目】X、Y、Z三种元素的离子都和氩原子具有相同的电子层排布。X元素单质能在氢气中燃烧,产生苍白色火焰;Y元素氢化物的分子式是H2Y,其最高氧化物含有40%的Y;Z元素的离子具有紫色的焰色反应。
(1)根据以上条件,推断元素名称:X:_____,Y:_____,Z:________。
(2)X、Y、Z最高价氧化物对应的水化物的酸性由强到弱的顺序是________。
(3)用电子式表示Z2Y的形成过程:___________,其化合物中化学键的类型是________。
【答案】C
【解析】试题分析:X、Y、Z三种元素的离子都和氩原子具有相同的电子层排布,X元素的单质能在氢气中燃烧,产生苍白色火焰,则X为Cl元素;Y元素氢化物的分子是H2Y,则Y的最高化合价是+6价,其最高价氧化物含有40%的Y,最高价氧化物为YO3,令Y的相对原子质量为a,则A÷(a×48)=40%,解得a=32,故Y为S元素;Z元素的离子具有紫色的焰色反应,说明Z是钾元素。(1)由上述分析可知,X是氯;Y为硫,Z为钾;(2)X、Y、Z最高价氧化物对应的水化物分别是HClO4、H2SO4、KOH。非金属性Cl>S,故酸性HClO4>H2SO4,KOH属于碱,故酸性由强到弱的顺序是:HClO4>H2SO4>KOH;(3)K2S属于离子化合物,用K、S原子的电子式表示其形成过程:![]() ,化合物中化学键的类型是离子键。
,化合物中化学键的类型是离子键。

【题目】现在部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是________________。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式______ _____。
(3)元素Z与元素T相比,非金属较强的是______________(用元素符号表示);下列表述中能证明这一事实的是___________。
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异是学习的重要方法之一,T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是_______________(填化学式),理由是_____________。T的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为_______ _ ______。