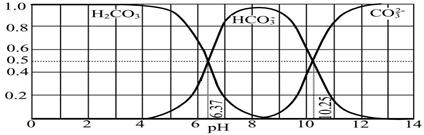
题目内容
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇, 一定条件下发生如下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)写出该反应的平衡常数表达式:K= ;已知:K(300℃)>K(350℃),则该反应是_______反应。(填“吸热”或“放热”)
(2)下列情况不能说明该反应一定达到平衡的是
A混合气体的平均平均相对分子质量不变 B混合气体的压强不变
C单位时间内生成3mol H—H键,同时生成2 mol C=O键
D.混合气体中 c (H2) : c (CH3OH) = 3:1
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为 mol·L-1·min-1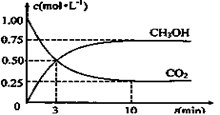
(4)下列措施中能使(3)题中n(CH3OH)/n(CO2)增大的有 。(填字母)
A升高温度 B加入催化剂 C将H2O(g)从体系中分离
D充入He(g),使体系总压强增大 E.再充入1molCO2和3molH2
(5)若在另一个密闭容器中充入1 mol CO2和3 mol H2,保持压强不变,并使初始体积与(3)题中容器体积相等,且在相同的温度下进行反应,达到平衡时该容器中的CO2的体积百分数 ________(3)题中的CO2的体积百分数。(填“>”或“<”或“=”)
(1)K=c(CH3OH)c(H2O)/c(CO2)c3(H2);放热;(2)CD;(3)0.225;(4)CE;(5)<。
解析试题分析:(1)根据反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)和化学平衡常数的定义写出该反应的平衡常数表达式:K=c(CH3OH)c(H2O)/c(CO2)c3(H2);已知:K(300℃)>K(350℃),则升高温度,平衡逆向移动,升高温度,平衡向吸热反应方向移动,则该反应是放热反应;(2)A、根据M=m/n判断,随着反应的进行,混合气体的质量不变,物质的量发生变化,混合气体的平均相对分子质量不断变化,当混合气体的平均相对分子质量不变,反应已达平衡状态,错误;B、根据阿伏加德罗定律,同温同体积条件下,气体的压强之比等于物质的量之比,随着反应的进行气体的物质的量不断变化,混合气体的压强不断变化,当混合气体的压强不变时,反应已达平衡状态,错误;C、单位时间内生成3mol H—H键,同时生成2 mol C=O键 ,二者均为逆反应速率,不能说明该反应一定达到平衡,正确;D、混合气体中 c (H2) : c (CH3OH) = 3:1[,不能说明该反应一定达到平衡,正确;选CD;(3)根据题给图像知,10min时反应达到平衡状态,甲醇的浓度变化为0.75mol·L—1,根据公式v=△c/△t计算,v(CH3OH)=0.075 mol·L-1·min-1,利用速率之比等于化学计量数之比计算,v(H2)= 3v(CH3OH)= 0.225 mol·L-1·min-1;(4)A、该反应为放热反应,升高温度,平衡逆向移动,n(CH3OH)/n(CO2)减小,错误;B、加入催化剂 ,平衡不移动,n(CH3OH)/n(CO2)不变,错误;C、将H2O(g)从体系中分离,平衡正向移动,n(CH3OH)/n(CO2)增大,正确;D、等温等容条件下,充入He(g),虽然体系总压强增大,但与反应相关的物质的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,错误;E、等温等容条件下,再充入1molCO2和3molH2相当于增大压强,平衡正向移动,n(CH3OH)/n(CO2)增大,正确,选CE;(5)若一个密闭容器中充入1 mol CO2和3 mol H2,保持压强不变,随着反应的进行,容器内气体的物质的量不断减小,容器的体积不断减小,相当于增大压强,平衡正向移动,达到平衡时该容器中的CO2的体积百分数 < (3)题中的CO2的体积百分数。
CH3OH(g)+H2O(g)和化学平衡常数的定义写出该反应的平衡常数表达式:K=c(CH3OH)c(H2O)/c(CO2)c3(H2);已知:K(300℃)>K(350℃),则升高温度,平衡逆向移动,升高温度,平衡向吸热反应方向移动,则该反应是放热反应;(2)A、根据M=m/n判断,随着反应的进行,混合气体的质量不变,物质的量发生变化,混合气体的平均相对分子质量不断变化,当混合气体的平均相对分子质量不变,反应已达平衡状态,错误;B、根据阿伏加德罗定律,同温同体积条件下,气体的压强之比等于物质的量之比,随着反应的进行气体的物质的量不断变化,混合气体的压强不断变化,当混合气体的压强不变时,反应已达平衡状态,错误;C、单位时间内生成3mol H—H键,同时生成2 mol C=O键 ,二者均为逆反应速率,不能说明该反应一定达到平衡,正确;D、混合气体中 c (H2) : c (CH3OH) = 3:1[,不能说明该反应一定达到平衡,正确;选CD;(3)根据题给图像知,10min时反应达到平衡状态,甲醇的浓度变化为0.75mol·L—1,根据公式v=△c/△t计算,v(CH3OH)=0.075 mol·L-1·min-1,利用速率之比等于化学计量数之比计算,v(H2)= 3v(CH3OH)= 0.225 mol·L-1·min-1;(4)A、该反应为放热反应,升高温度,平衡逆向移动,n(CH3OH)/n(CO2)减小,错误;B、加入催化剂 ,平衡不移动,n(CH3OH)/n(CO2)不变,错误;C、将H2O(g)从体系中分离,平衡正向移动,n(CH3OH)/n(CO2)增大,正确;D、等温等容条件下,充入He(g),虽然体系总压强增大,但与反应相关的物质的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,错误;E、等温等容条件下,再充入1molCO2和3molH2相当于增大压强,平衡正向移动,n(CH3OH)/n(CO2)增大,正确,选CE;(5)若一个密闭容器中充入1 mol CO2和3 mol H2,保持压强不变,随着反应的进行,容器内气体的物质的量不断减小,容器的体积不断减小,相当于增大压强,平衡正向移动,达到平衡时该容器中的CO2的体积百分数 < (3)题中的CO2的体积百分数。
考点:考查化学反应速率和化学平衡。

工业生产硫酸时,其中一步反应是2SO2 + O2 2SO3,该反应正反应是放热反应,下列说法不正确的是( )
2SO3,该反应正反应是放热反应,下列说法不正确的是( )
| A.升高温度可提高反应速率 |
| B.使用催化剂能增大反应速率 |
| C.增大氧气浓度可提高SO2的转化率 |
| D.达到化学平衡时正逆反应速率相等且都为零 |
(8分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,且气体体积为标况体积):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
原因是 。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体
积的下列溶液,你认为可行的是__________。
A.蒸馏水 B.NaCl溶液 C.NaNO3溶液 D.CuSO4溶液 E.Na2CO3溶液
(10分)某同学设计了如图所示的装置(夹持装置已略去)来探究影响化学反应速率的因素。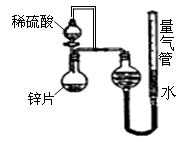
(1)圆底烧瓶中发生反应的离子方程式是
__________________________________________
(2)用上述装置进行实验,以生成15.0mL气体为计时终点,
结果为t1﹥t2
| 序号 | Ⅴ(H2SO4)/mL | C(H2SO4)/mol·L-1 | t/s |
| Ⅰ | 10 | 1 | t1 |
| Ⅱ | 10 | 3 | t2 |
比较实验Ⅰ和实验Ⅱ可以得出的结论是__________________________________________
(3)实验中向烧瓶中滴入的稀硫酸的体积(其他操作都正确),对测定气体体积的影响_____ __________ (填“偏大”、“偏小”、“无影响”)
(4)将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含的杂质可能是(填序号)________
a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(5)要加快该反应的反应速率,还可以采取的措施有________________________(任填一种即可)
 xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c (A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c (A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求: pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值 ,混合气体的密度 ;降温时,混合气体的平均相对分子质量 ;加入催化剂,气体的总物质的量 ;充入C,则A、B的物质的量 。(填增大、减小、不变、不确定)
pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值 ,混合气体的密度 ;降温时,混合气体的平均相对分子质量 ;加入催化剂,气体的总物质的量 ;充入C,则A、B的物质的量 。(填增大、减小、不变、不确定) (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
 CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题: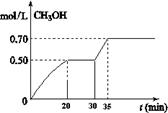
 Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。