题目内容
(8分)将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应: 3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c (A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c (A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:n(A)= n(B)=________mol;
(2)B的平均反应速率v(B)=________mol/(L·min);
(3)x的值为________。
(1) 0.75 ; 3 ; (2) 0.05 ; (3) 2。
解析试题分析:V(D)=" 0.5" mol/L÷5 min="0.1mol/(L·min),V(C)=" 0.1 mol/(L·min),因此x="2;V(B)=1/2" V(C)=" 0.05" mol/(L·min)。假设反应开始前A、B的物质的量都是2amol,在反应过程是B的浓度改变ymol/L.则反应过程中各种物质的浓度变化关系是: 3A(g)+B(g) 2C(g)+2D(g)
2C(g)+2D(g)
开始浓度(mol/L): a a 0 0
改变浓度(mol/L)3y y 2y 2y
平衡浓度(mol/L)(a-3y) (a-y) 2y 2y
2y="0.5" mol/L,所以y="0.25" mol/L. (a-3y) : (a-y)= 3∶5,将y="0.25" mol/L代入该反应式可得:a="1." 5mol/L。因此5 min时A的浓度c(A)=1. 5-3×0.25=0.75mol/L;反应开始前容器中的A、B的物质的量:n(A)= n(B)=2a=3mol。
考点:考查化学反应速率与方程式的系数的关系、物质的物质的量浓度的计算的知识。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案100mL 6 mol / L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
| A.硫酸钾溶液 | B.醋酸 | C.氯化钠(固体) | D.盐酸 |
(6分)某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表:
| 实验 序号 | 铁的质量/g | 铁的 形态 | V(H2SO4) /mL | c(H2SO4) /mol·L-1 | 反应前溶液 的温度/℃ | 金属完全消 失的时间/s |
| 1 | 0.10 | 片状 | 50 | 0.8 | 20 | 200 |
| 2 | 0.10 | 粉状 | 50 | 0.8 | 20 | 25 |
| 3 | 0.10 | 片状 | 50 | 1.0 | 20 | 125 |
| 4 | 0.10 | 片状 | 50 | 1.0 | 35 | 50 |
(1)实验1、2 表明 对反应速率有影响。
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号)。
(3)该探究实验中,影响反应速率的因素还有 ,体现该影响因素的实验有 (填实验序号)。
(4)进行实验3时,若将稀硫酸改为50 mL 2.0 mol·L-1 盐酸(其他条件不变),发现:放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是 。(忽略温度对反应速率的影响)
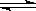 3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是
3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是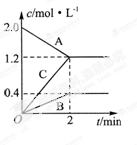
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)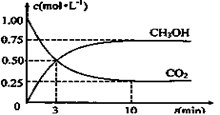
 xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白: