题目内容
(18分)能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下前实现如下变废为宝的过程:
mCeO2 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述过程的总反应是 ,该反应将太阳能转化为 。
(2)CO、O2和KOH溶液构成的燃料电池的负极电极反应式为 。该电池反应可获得K2CO3溶液,某温度下0.5mol L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。
①电解过程中发生反应的离子方程式是 ,阴极附近溶液PH (填“不变”、“升高”或“下降”)。
②如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的 。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式 。
③图中氢氧化钠溶液的质量分数a% b%(填“>”、‘‘=”或“<”),,燃料电池中负极上发生的电极反应为 。
(18分)
(1)H2O + CO2 =H2 + CO + O2(2分) 化学能(1分)
(2)CO – 2e- +4OH- = CO32- + 2H2O(2分) 2×10-4 mol·L-1(2分)
(3)①2Cl-+2H2O  Cl2↑+ H2↑+2OH-(2分) 升高(1分)
Cl2↑+ H2↑+2OH-(2分) 升高(1分)
② ac(2分) BaCO3(s)+ SO42-(aq) = BaSO4 (s)+ CO32-(aq)(2分)
③ <(2分) H2-2e-+2OH-=2H2O (2分)
解析试题分析:(1)两式相加可得总反应方程式:H2O + CO2 =H2 + CO + O2;通过该反应把太阳能转化为了化学能。
(2)在碱性条件下,CO失电子转化为CO32?,电解方程式为:CO – 2e- +4OH- = CO32- + 2H2O;溶液的pH=12,则c(OH?)=0.01mol?L?1,若忽略CO32-的第二级水解,c(HCO3?)=0.01mol?L?1,则Kh=c(HCO3?)?c(OH?)/c(CO32?)= 0.01mol?L?1×0.01mol?L?1/0.5mol?L?1= 2×10-4 mol·L-1。
(3)①电解食盐水生成H2、H2和NaOH,所以离子方程式为:2Cl-+2H2O  Cl2↑+ H2↑+2OH-;阴极上H2O电离出的H+得电子生成H2,使H2O的电离平衡向右移动,OH?浓度增大,所以pH升高。
Cl2↑+ H2↑+2OH-;阴极上H2O电离出的H+得电子生成H2,使H2O的电离平衡向右移动,OH?浓度增大,所以pH升高。
②Ba(OH)2可与SO42?反应,OH?可加盐酸除去,BaCl2可与SO42?反应,而且不引入新杂质,Ba(NO3)2能与SO42?反应,但NO3?无法除去,故ac正确;BaCO3转化为更难溶的BaSO4,离子方程式为:BaCO3(s)+ SO42-(aq) = BaSO4 (s)+ CO32-(aq)。
③在燃料电池中,氧气作正极,所以通入空气的极是正极,O2得电子生成OH?,通入燃料的电极是负极,消耗OH?,所以a% < b%;负极是燃料氢气发生失电子的氧化反应,电极反应式为H2-2e-+2OH-=2H2O。
考点:本题考查电解池和原电池原理、平衡常数计算、方程式的书写。

 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案在一个固定容积的密闭容器中充入2molNO2,一定温度下建立如下平衡:2NO2 N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是( )
N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是( )
| A.x>y | B.x<y | C.x=y | D.不能确定 |
(5分)氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家。
(1)右图表示温度为T K时氮气与氢气合成氨反应过程中的能量变化, 写出该反应的热化学方程式 。
(2)已知在TK温度下合成氨反应在2.00L的密闭容器中进行。得到如下数据:
| 时间(h) 物质的量(mol) | | 0 | 1 | 2 | 3 | 4 |
| N2 | | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
①0~1h内N2的平均反应速率为mol/(L·h)。
②反应进行到2h时放出的热量为 kJ。
③此条件下,反应:N2 + 3H2
 2NH3的化学平衡常数K = (保留两位小数)。
2NH3的化学平衡常数K = (保留两位小数)。④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡移动的方向是 (填“正反应”或“逆反应”或“不移动”)。
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出大试管中发生反应的化学方程式: ,该反应是 反应(填放热或吸热)。
(2)实验结果表明,催化剂的催化效果与 有关。
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行, 在从0—3分钟各物质的量的变化情况如图所示(A,B,C均为气体)。
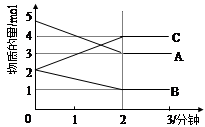
(3)该反应的的化学方程式为 ;
(4)反应开始至2分钟时,B的平均反应速率为 。
(5)能说明该反应已达到平衡状态的是 。
a.v(A)= 2v(B) b.容器内压强保持不变
c.v逆(A)= v正(C) d.容器内混合气体的密度保持不变
(6)由图求得A的平衡时的转化率为 。
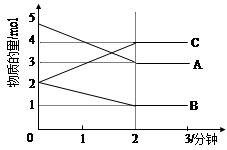

 Fe( s) +CO2(g)的平衡常数K= 0.25。
Fe( s) +CO2(g)的平衡常数K= 0.25。 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)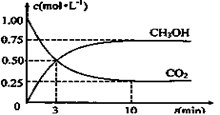
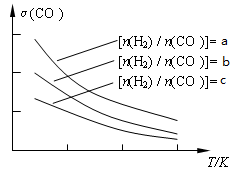
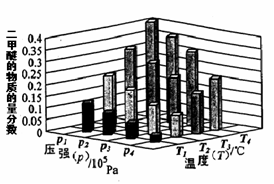
 CH3OCH3(g) + H2O(g)。已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2) / n(CO)]的变化曲线如下左图:
CH3OCH3(g) + H2O(g)。已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2) / n(CO)]的变化曲线如下左图: