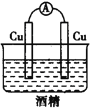
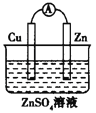
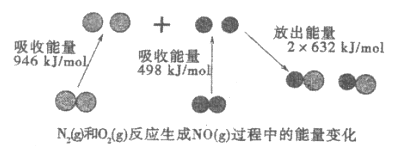
题目内容
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有一个电子,但次外层有18个电子.回答下列问题:
(1)b、c、d中第一电离能由大到小的顺序是:________________(填元素符号),e的价层电子轨道示意图为__________________________________, e的焰色反应为亮绿色,请用原子结构的知识解释原因_____________________________
(2)a和b、c、d、e形成的二元共价化合物有很多种,其中有一分子呈三角锥形,该分子的中心原子的杂化方式为__________;其中有两种分子,既含有极性共价键、又含有非极性共价键的化合物是_____________________(填化学式).
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的两种酸是_____;请从物质结构与性质的关系解释,这两种酸酸性强弱的原因是______________________________
【答案】N>O>S ![]() 电子从高能级跃迁回低能级,以光的形式释放能量 sp3 H2O2、N2H4 HNO2、HNO3 HNO3可以表示为(HO)NO2,HNO2可以表示为(HO)NO,HNO3中非羟基氧数目大,N元素化合价为+5价,正电性更大,导致N﹣O﹣H中O的电子向N偏移,在水分子作用下,更易电离出H+,即酸性越强
电子从高能级跃迁回低能级,以光的形式释放能量 sp3 H2O2、N2H4 HNO2、HNO3 HNO3可以表示为(HO)NO2,HNO2可以表示为(HO)NO,HNO3中非羟基氧数目大,N元素化合价为+5价,正电性更大,导致N﹣O﹣H中O的电子向N偏移,在水分子作用下,更易电离出H+,即酸性越强
【解析】
周期表前四周期的元素a、b、c、d、e原子序数依次增大,a的核外电子总数与其周期数相同,则a是H元素,c的最外层电子数为其内层电子数的3倍,所以C是O元素,d与c同族,则d是S元素,b的价电子层中的未成对电子有3个,且原子序数小于c,则b是N元素;e的最外层只有一个电子,但次外层有18个电子,则e是Cu元素。
(1)同主族元素从上到下第一电离能减小,第一电离能O>S,同周期元素从左到右第一电离能增大,N原子2p轨道为半满状态,第一电离能大于相邻元素,第一电离能N>O,所以N、O、S中第一电离能由大到小的顺序是N>O>S,e是Cu元素,根据洪特规则,价层电子轨道示意图为![]() ;电子从高能级跃迁回低能级,以光的形式释放能量,所以铜的焰色反应为亮绿色;
;电子从高能级跃迁回低能级,以光的形式释放能量,所以铜的焰色反应为亮绿色;
(2)H和N、O、S形成的二元共价化合物有很多种,其中NH3分子呈三角锥形,该分子的N原子的杂化轨道数是![]() ,杂化方式为sp3;其中既含有极性共价键、又含有非极性共价键的化合物是H2O2、N2H4。
,杂化方式为sp3;其中既含有极性共价键、又含有非极性共价键的化合物是H2O2、N2H4。
(3)这些元素形成的含氧酸中,HNO2、HNO3分子的中心原子的价层电子对数为3;HNO3可以表示为(HO)NO2,HNO2可以表示为(HO)NO,HNO3中非羟基氧数目大,N元素化合价为+5价,正电性更大,导致N﹣O﹣H中O的电子向N偏移,在水分子作用下,更易电离出H+,即酸性更强。

【题目】下表是元素周期表一部分,列出了九种元素在周期表中的位置:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
请用化学用语回答下列问题
(1)在上述元素中,金属性最强的是____________。
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是________(填物质化学式)。写出⑥和⑧的最高价氧化物对应的水化物反应的离子方程式 _______________________________。
(3)只由④形成的18电子微粒的电子式 _______________。
(4)写出由①和③形成的离子化合物的化学式 ____________________________。
(5)用电子式表示⑦和⑨形成的化合物的形成过程_________________________________。
(6)表中元素③和⑤可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式 _________________。
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。
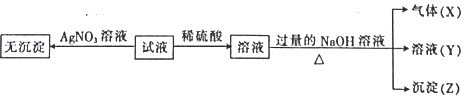
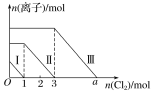
实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的 NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是_____________。检验气体X的方法是______________________;沉淀Z的化学式为_________________。
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________________。
(4) A点对应的固体质量为__________g。
(5)通过上述信息,推算该溶液中阴离子的浓度为______________mol L-l。