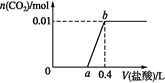
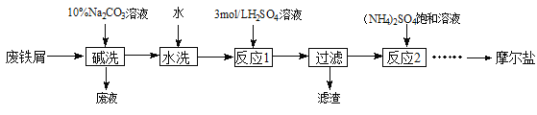
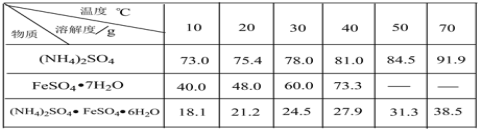题目内容
【题目】下表是元素周期表一部分,列出了九种元素在周期表中的位置:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
请用化学用语回答下列问题
(1)在上述元素中,金属性最强的是____________。
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是________(填物质化学式)。写出⑥和⑧的最高价氧化物对应的水化物反应的离子方程式 _______________________________。
(3)只由④形成的18电子微粒的电子式 _______________。
(4)写出由①和③形成的离子化合物的化学式 ____________________________。
(5)用电子式表示⑦和⑨形成的化合物的形成过程_________________________________。
(6)表中元素③和⑤可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式 _________________。
【答案】Na HClO4 Al(OH)3 + OH- = AlO2- + 2H2O ![]() NH4H
NH4H ![]() F—N=N—F
F—N=N—F
【解析】
由元素在周期表中的位置可知,①②③④⑤⑥⑦⑧⑨分别为:H、C、N、O、F、Na、Mg、Al、Cl,据此解答。
(1)金属性最强的元素位于周期表中左下角,即Na,故答案为:Na;
(2)元素周期表中,所有元素的最高价氧化物对应的水化物酸性最强的是HClO4。⑥(Na)和⑧(Al)的最高价氧化物对应的水化物分别为NaOH和Al(OH)3,二者反应的离子方程式为:Al(OH)3 + OH- = AlO2- + 2H2O,故答案为:HClO4;Al(OH)3 + OH- = AlO2- + 2H2O;
(3)④是O,只由O形成的18电子微粒是O22-,其电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)①是H,③是N,H和N都是非金属元素,二者形成的离子化合物必然有铵根,则该物质应为NH4H,故答案为:NH4H;
(5)⑦是Mg,⑨是Cl,二者形成MgCl2,MgCl2是离子化合物,其形成过程可表示为:![]() ,故答案为:
,故答案为:![]() ;
;
(6)Y中各原子均达到“8电子稳定结构”,③是N,最外层电子数为5,差3个电子稳定,则每个N原子必形成3对共用电子对,⑤是F,最外层电子数为7,差1个电子稳定,则每个F原子必形成1对共用电子对,其结构式必然为:F—N=N—F,故答案为:F—N=N—F。

【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ![]() 探究1:验证同周期X、Y、Z三种元素金属性递变规律
探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Y剧烈 |
2、各取1.0g的金属Z和金属Y形状相同,分别加入到5mL 1.0mol/L盐酸中。 | 金属Y与盐酸反应比金属Z剧烈 |
(1)通过实验验证三种元素金属性由强到弱是_______________________,
(2)下列判断正确的是______
A.原子序数:![]()
![]() 原子的最外层电子数
原子的最外层电子数![]()
C.原子半径:X>Y>Z D. Z的最高价氧化物对应水化物的碱性最强
Ⅱ![]() 探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
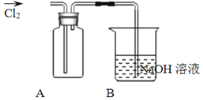
![]() 装置A中盛放的试剂是______
装置A中盛放的试剂是______![]() 填选项
填选项![]()
A.![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液
B中反应的离子方程式是__________________________________________________。
![]() 下列不能用于验证氯元素比硫元素非金属性强的依据为______
下列不能用于验证氯元素比硫元素非金属性强的依据为______![]() 填选项
填选项![]()
A.HCl酸性比![]() 强 B.HClO氧化性比
强 B.HClO氧化性比![]() 强
强
C.HClO3酸性比![]() 强 D.铁与
强 D.铁与![]() 反应生成
反应生成![]() ,而硫与铁反应生成FeS
,而硫与铁反应生成FeS
![]() 若要验证非金属性:
若要验证非金属性:![]() ,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液______的现象,即可证明。用原子结构理论解释非金属性
,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液______的现象,即可证明。用原子结构理论解释非金属性![]() 的原因:同主族元素从上到下,____________________。
的原因:同主族元素从上到下,____________________。