��Ŀ����
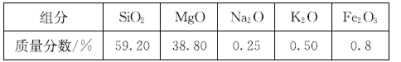
����Ŀ���ߴ��������������������ˡ�ij����ʯ�ijɷּ��±���
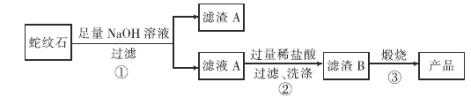
ͨ����ͼ���̿�������ʯ�Ʊ��ϴ����Ķ������衣
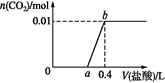
(1)����ʯ���漰�Ŀ����Խ����������� _______________________________ (д��ѧʽ)��
(2)��������漰SiO2��Ӧ�����ӷ���ʽΪ _____________________________ ��
(3)����A�ijɷ���________________(�ѧʽ)��
(4)�������ϴ�ӳ����ķ�����_________________________________________________ ��
(5)ʵ���ҽ��в������Ҫ�õ��������������������ǡ��ƾ��ơ���������_____________��_____________��
���𰸡�K2O ��Na2O SiO2 +2OH- = SiO32- + H2O MgO ��Fe2O3 ��©����ע������ˮ��û����������ˮ��Ȼ���£��ظ�����2~3�� ���ż� ����ǯ
��������
����ʯ���������������ƽ��ݣ����˵�AΪ��������Һ����������Һ�м����������ɹ�����������ˡ�ϴ�ӵ�����BΪ���ᣬ���չ���ɵö������衣
��1���ӱ��пɵó�������ʯ���漰�Ŀ����Խ�����������K2O ��Na2O���ʴ�Ϊ��K2O ��Na2O��
��2����������Ϊ������������������Ʒ�Ӧ���ɹ����ƺ�ˮ����������漰SiO2��Ӧ�����ӷ���ʽΪSiO2 +2OH- = SiO32- + H2O���ʴ�Ϊ��SiO2 +2OH- = SiO32- + H2O��
��3�������ơ������ؾ�����ˮ��Ӧ���ɿ����Լ��������Ϊ�������������������Ʒ�Ӧ���ɿ����Թ����ƣ�����þ���������������������Ʋ���Ӧ������A�ijɷ���MgO ��Fe2O3(�ѧʽ)���ʴ�Ϊ��MgO ��Fe2O3��
��4���������ϴ�ӳ����ķ�������©����ע������ˮ��û����������ˮ��Ȼ���£��ظ�����2~3�Ρ��ʴ�Ϊ����©����ע������ˮ��û����������ˮ��Ȼ���£��ظ�����2~3�Σ�
��5������ȶ������ֽ����ɶ��������ˮ������ʽ��H2SiO3![]() H2O+SiO2�����չ�����Ҫ�������У�����ǯ���ƾ��ơ����żܡ������������ǡ��ʴ�Ϊ�����żܣ�����ǯ��
H2O+SiO2�����չ�����Ҫ�������У�����ǯ���ƾ��ơ����żܡ������������ǡ��ʴ�Ϊ�����żܣ�����ǯ��