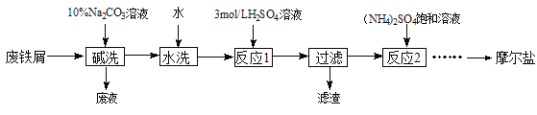
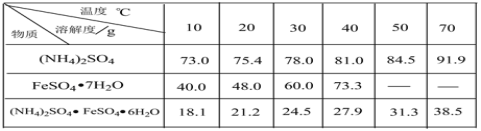ЬтФПФкШн
ЁОЬтФПЁПФГвЛЗДгІЬхЯЕжаЕФЮяжЪгаHClЁЂSnCl2ЁЂH2SnCl6ЁЂAsЁЂH3AsO3ЁЂH2OЃЌвбжЊЃКHClЪЧЗДгІЮяжЎвЛЃЛAsЪЧЩњГЩЮяжЎвЛЁЃ
ЃЈ1ЃЉЂйаДГіЮДХфЦНЕФИУЗДгІЕФЛЏбЇЗНГЬЪНЃК_________________________
ЂкдкИУЗДгІжаЃЌЕУЕчзгЕФЮяжЪЪЧ__________ЃЌБЛбѕЛЏЕФдЊЫиЪЧ____________ЁЃ
ЂлдкЗДгІжаЃЌУПзЊвЦ1 molЕчзгЃЌЯћКФHCl________molЁЃ
ЂмЯТСаа№ЪіжаВЛе§ШЗЕФЪЧ_____________________(ЬюаДзжФИађКХ)ЁЃ
a.дкЯрЭЌЬѕМўЯТЃЌЕкЂїAзхдЊЫиЕФвѕРызгЕФЛЙдадДгЩЯЕНЯТж№НЅдіЧП
b.ЕУЕчзгдНЖрЕФбѕЛЏМСЃЌЦфбѕЛЏаддНЧП
c.бєРызгжЛФмзїбѕЛЏМС
d.дкЯрЭЌЬѕМўЯТЃЌбѕЛЏадЫГађЃКFe3+>Cu2+>H+>Fe2+
ЃЈ2ЃЉЂйЯђЪЂгаKIШмвКЕФЪдЙмжаМгШыЩйаэCCl4КѓЕЮМгТШЫЎЃЌCCl4ВуБфГЩзЯЩЋЁЃИУЗДгІЕФРызгЗНГЬЪНЮЊ_________________________ЃЌШчЙћМЬајЯђЪдЙмжаЕЮМгТШЫЎЃЌеёЕДЃЌCCl4ВуЛсж№НЅБфЧГЃЌзюКѓБфГЩЮоЩЋЁЃИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ____________________ЁЃ
ЂкАбKIЛЛГЩKBrЃЌдђCCl4ВуБфЮЊ_______________ЩЋЃЛМЬајЕЮМгТШЫЎЃЌCCl4ВуЕФбеЩЋУЛгаБфЛЏЁЃCl2ЁЂHIO3ЁЂHBrO3бѕЛЏадгЩЧПЕНШѕЕФЫГађЪЧ___________________ЁЃ
ЁОД№АИЁП.HCl+SnCl2+H3AsO3![]() H2SnCl6+As+H2O H3AsO3 Sn 2 b.c Cl2+2I-=I2+2Cl- 5Cl2+I2+6H2O=2HIO3+10HCl ГШ HBrO3>Cl2>HIO3
H2SnCl6+As+H2O H3AsO3 Sn 2 b.c Cl2+2I-=I2+2Cl- 5Cl2+I2+6H2O=2HIO3+10HCl ГШ HBrO3>Cl2>HIO3
ЁОНтЮіЁП
ЃЈ1ЃЉЂйHClЪЧЗДгІЮяжЎвЛЃЌИљОнЧтдЊЫиЁЂТШдЊЫиЕФМлЬЌЃЌПЩжЊHClдкЗДгІжаЦ№ЫсЕФзїгУЃЌHClжаЧтдЊЫиЩњГЩЫЎЃЌгЩдЊЫиЪиКужЊH3AsO3ЪЧЗДгІЮяЃЌИљОнAsЁЂSnдЊЫиЛЏКЯМлМАЕчзгзЊвЦЪиКуПЩжЊЃЌH3AsO3ЪЧбѕЛЏМСЃЌБЛЛЙдЮЊAsЃЌSnCl2ЪЧЛЙдМСБЛбѕЛЏЮЊH2SnClЃЌЫљвдЮДХфЦНЕФЗДгІЗНГЬЪНЮЊHCl+SnCl2+H3AsO3![]() H2SnCl6+As+H2OЃЌ
H2SnCl6+As+H2OЃЌ
ЙЪД№АИЮЊЃКHCl+SnCl2+H3AsO3![]() H2SnCl6+As+H2OЃЛ
H2SnCl6+As+H2OЃЛ
ЂкНсКЯЗНГЬЪНЃЌИљОнAsЁЂSnдЊЫиЛЏКЯМлПЩжЊЃЌH3AsO3ЪЧбѕЛЏМСЃЌБЛЛЙдЮЊAsЃЌ+2ЕФSnЛЏКЯМлЩ§ИпЮЊ+4БЛбѕЛЏЃЌ
ЙЪД№АИЮЊЃКH3AsO3ЃЛSnЃЛ
ЂлгЩЗНГЬЪНПЩжЊAsдЊЫигЩH3AsO3жа+3МлЃЌНЕЕЭЮЊAsжа0МлЃЌУП1mol
H3AsO3ЗДгІЪБЃЌашвЊЯћКФHCl6molЃЌМДзЊвЦ3molЕчзгЯћКФ6molHClЃЌЫљвдУПзЊвЦ1molЕчзгЃЌЯћКФ2mol HClЃЌ
ЙЪД№АИЮЊЃК2ЃЛ
Ђм aЁЂЗЧН№ЪєаддНЧПЃЌЯргІвѕРызгЕФЛЙдаддНШѕЃЌдкЯрЭЌЬѕМўЯТЃЌЕкVIIAзхдЊЫиДгЩЯЕНЯТЗЧН№Ъєадж№НЅМѕШѕЃЌЫљвдвѕРызгЕФЛЙдаддіЧПЃЌЙЪaе§ШЗЃЛ
bЁЂбѕЛЏаддНЧПЕУЕчзгФмСІдНЧПЃЌгыЕУЕчзгЖрЩйЮоЙиЃЌЙЪbДэЮѓЃЛ
cЁЂжаМфМлЬЌЕФЃЌМШОпгабѕЛЏадгжОпгаЛЙдадЃЌШчЃКFe2+ЃЌЙЪcДэЮѓЃЛ
dЁЂCuгыFe3+ЗДгІCu+2Fe3+ЈTCu2++2Fe2+ЃЌбѕЛЏМСЪЧFe3+ЃЌбѕЛЏВњЮяЪЧCu2+ЃЌбѕЛЏМСЕФбѕЛЏадДѓгкбѕЛЏВњЮяЕФбѕЛЏадЃЌЫљвдбѕЛЏадFe3+ЃОCu2+ЃЌЛюЦУадН№ЪєЬњЧПгкЧтЃЌЧтЧПгкН№ЪєЭЃЌЫљвдбѕЛЏадCu2+ЃОH+ЃОFe2+ЃЌЙЪбѕЛЏадЫГађЃКFe3+ЃОCu2+ЃОH+ЃОFe2+ЃЌЙЪdе§ШЗЁЃ
ЙЪД№АИЮЊЃКb cЁЃ
ЃЈ2ЃЉЂйТШЦјОпгаЧПбѕЛЏадЃЌЯђЪЂгаKIШмвКЕФЪдЙмжаМгШыЩйаэCCl4КѓЕЮМгТШЫЎЃЌCCl4ВуБфГЩзЯЩЋЃЌЫЕУїЩњГЩI2ЃЛМЬајЯђЪдЙмжаЕЮМгТШЫЎЃЌеёЕДЃЌ CCl4ВуЛсж№НЅБфЧГЃЌзюКѓБфГЩЮоЩЋЃЌЫЕУїI2БЛНјвЛВНбѕЛЏЃЌЩњГЩHIO3ЃЌЭЌЪБТШЦјБЛЛЙдЮЊHClЃЌЗДгІЮяЮЊТШЦјКЭЕтЁЂЫЎЃЌЩњГЩЮяЪЧЕтЫсКЭТШЛЏЧтЃЌвЛИіТШЦјЗжзгВЮМгЗДгІЕУ2ИіЕчзгЃЌвЛИіЕтЗжзгВЮМгЗДгІЪЇШЅ10ИіЕчзгЃЌИУЗДгІжаЕУЪЇЕчзгЕФзюаЁЙЋБЖЪ§ЪЧ10ЃЌЫљвдЗНГЬЪНЮЊЃЌ5Cl2+I2+6H2O=2HIO3+10HCl
ЙЪД№АИЮЊЃКCl2+2I-=I2+2Cl- ЃЛ5Cl2+I2+6H2O=2HIO3+10HCl
ЂкТШЦјЕФбѕЛЏадДѓгкфхЃЌЫљвдТШЦјФмбѕЛЏфхРызгЩњГЩфхЕЅжЪЃЌЗЂЩњЕФРызгЗДгІЗНГЬЪНЮЊCl2+2Br=Br2+2ClЃЌфхЫЎГЪГШЩЋЃЌМЬајЯђфхЫЎжаЕЮМгТШЫЎЃЌCCl4ВуЕФбеЩЋУЛгаБфЛЏЃЌЫЕУїТШЦјЕФбѕЛЏадаЁгкфхЫсЃЌТШЦјФмКЭЕтЗДгІЩњГЩЕтЫсЃЌЫљвдТШЦјЕФбѕЛЏадДѓгкЕтЫсЃЌЫљвдCl2ЁЂHIO3ЁЂHBrO3бѕЛЏадгЩЧПЕНШѕЕФЫГађ HBrO3>Cl2>HIO3ЃЛ
ЙЪД№АИЮЊЃКГШЃЌ HBrO3>Cl2>HIO3ЁЃ

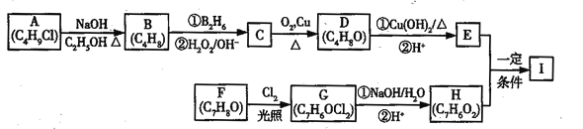
ЁОЬтФПЁП![]() ЪЧвЛжжЫЧСЯгЊбјЧПЛЏМСЁЃвЛжжРћгУЫЎюмПѓЃЈжївЊГЩЗжЮЊ
ЪЧвЛжжЫЧСЯгЊбјЧПЛЏМСЁЃвЛжжРћгУЫЎюмПѓЃЈжївЊГЩЗжЮЊ![]() ЁЂ
ЁЂ![]() ЃЌЛЙКЌЩйСП
ЃЌЛЙКЌЩйСП![]() ЁЂ
ЁЂ![]() ЁЂMnOЕШЃЉЃЌжЦШЁ
ЁЂMnOЕШЃЉЃЌжЦШЁ![]() ЕФЙЄвеСїГЬШчЭМ1ЃК
ЕФЙЄвеСїГЬШчЭМ1ЃК
вбжЊЃКЂйНўГівККЌгаЕФбєРызгжївЊга![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЕШЃЛ
ЕШЃЛ
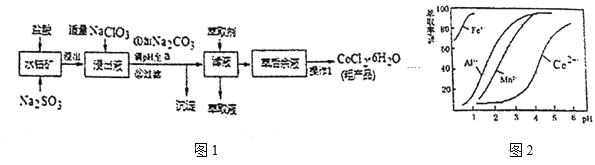
ЂкВПЗжбєРызгвдЧтбѕЛЏЮяаЮЪНГСЕэЪБШмвКЕФpHМћБэЃКЃЈН№ЪєРызгХЈЖШЮЊЃК0.01mol/LЃЉ
Ђл![]() ШлЕуЮЊ86ЁцЃЌМгШШжС110~120ЁцЪБЃЌЪЇШЅНсОЇЫЎЩњГЩЮоЫЎбѕЛЏюмЁЃ
ШлЕуЮЊ86ЁцЃЌМгШШжС110~120ЁцЪБЃЌЪЇШЅНсОЇЫЎЩњГЩЮоЫЎбѕЛЏюмЁЃ
ГСЕэЮя |
|
|
|
|
|
ПЊЪМГСЕэ | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
ЭъШЋГСЕэ | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
ЃЈ1ЃЉаДГіНўГіЙ§ГЬжа![]() ЗЂЩњЗДгІЕФРызгЗНГЬЪН____ЁЃ
ЗЂЩњЗДгІЕФРызгЗНГЬЪН____ЁЃ
ЃЈ2ЃЉаДГіNaClO3ЗЂЩњЗДгІЕФжївЊРызгЗНГЬЪН____ЃЌШєВЛЩїЯђЁАНўГівКЁБжаМгЙ§СПNaClO3ЪБЃЌПЩФмЛсЩњГЩгаЖОЦјЬхЃЌаДГіЩњГЩИУгаЖОЦјЬхЕФРызгЗНГЬЪН____ЁЃ
ЃЈ3ЃЉЁАМг![]() ЕїpHжСaЁБЃЌЙ§ТЫЫљЕУЕНЕФГСЕэГЩЗжЮЊ___ЁЃ
ЕїpHжСaЁБЃЌЙ§ТЫЫљЕУЕНЕФГСЕэГЩЗжЮЊ___ЁЃ
ЃЈ4ЃЉжЦЕУЕФ![]() дкКцИЩЪБашМѕбЙКцИЩЕФдДвђЪЧ___ЁЃ
дкКцИЩЪБашМѕбЙКцИЩЕФдДвђЪЧ___ЁЃ
ЃЈ5ЃЉнЭШЁМСЖдН№ЪєИпзгЕФнЭШЁТЪгыpHЕФЙиЯЕШчЭМ2ЁЃЯђЁАТЫвКЁБжаМгШынЭШЁМСЕФФПЕФЪЧ___ЉrЦфЪЙгУЕФзюМбpHЗЖЮЇЪЧ___ЁЃ
AЃЎ2.0~2.5 BЃЎ3.0~3.5 CЃЎ4.0~4.5 DЃЎ5.0~5.5