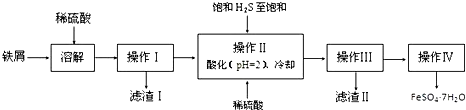
题目内容
12.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量的 SiO2、Fe2O3杂质)生产铵明矾晶体NH4Al(SO4)2•12H2O,其工艺流程图如下: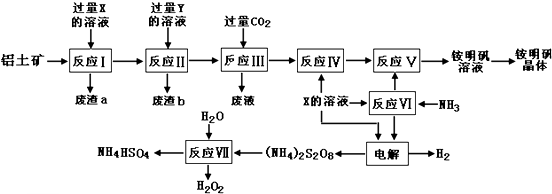
(1)废渣a、b 的成分分别是:二氧化硅、氢氧化铁.(写名称)
(2)流程图中X的化学式为:H2SO4.
(3)反应Ⅲ的离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;从铵明矾溶液中获得铵明矾晶体的操作依次为(填操作名称)蒸发浓缩、冷却结晶、过滤洗涤.
(4)过硫酸铵[(NH4)2S2O8]在工业生产中有广泛的用途,可以作为氧化剂和漂白剂,广泛地用于蓄电池工业;还用作聚合的引发剂、纤维工业的脱浆剂.在上述的工艺流程中用惰性电极电解X与反应Ⅵ所得物质的混合溶液可以得到过硫酸铵.写出阳极反应式:2SO42--2e-=S2O82-.
(5)反应Ⅶ的化学方程式为:(NH4)2S2O8+2H2O=2NH4HSO4+H2O2;NH4HSO4溶液中离子浓度由大到小顺序为:c(H+)>c(SO42-)>c(NH4+)>c(OH-).
(6)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是B(填选项字母)
A.4NH4Al(SO4)2+3Ba(OH)2═2(NH4)2SO4+3BaSO4↓+Al2 (SO4)3+2Al(OH)3↓
B.2NH4Al(SO4)2+4Ba(OH)2═(NH4)2SO4+3BaSO4↓+Ba(AlO2)2
C.2NH4Al(SO4)2+3Ba(OH)2═(NH4)2SO4+3BaSO4↓+2Al(OH)3↓
D.NH4Al(SO4)2+2Ba(OH)2═NH3•H2O+2BaSO4↓+Al(OH)3↓
分析 铝土矿(主要成分为Al2O3和少量的 SiO2、Fe2O3杂质)铝土矿的主要成分是氧化铝,根据题中流程图可知,在反应Ⅲ中通入二氧化碳,而流程最后要得到硫酸盐,所以为了除去杂质,先在铝土矿中加入过量的稀硫酸,得废渣a为SiO2,滤液中含有Al3+、Fe3+,所以X为稀硫酸,再加过量的氢氧化钠溶液,生成偏铝酸钠溶液和氢氧化铁沉淀,所以废渣b为氢氧化铁,Y为氢氧化钠,反应Ⅲ为偏铝酸钠溶液与过量二氧化碳反应生成氢氧化铝沉淀和废液,反应Ⅳ为氢氧化铝中加上硫酸可以制得Al2(SO4)3,反应Ⅵ中氨气与硫酸反应生成(NH4)2SO4,反应Ⅴ中(NH4)2SO4转化为铵明矾,电解硫酸和硫酸铵的混合溶液,在阴极上得氢气,阳极上得(NH4)2S2O8,反应ⅤⅡ为(NH4)2S2O8与水反应生成双氧水和NH4HSO4,据此答题.
解答 解:铝土矿(主要成分为Al2O3和少量的 SiO2、Fe2O3杂质)铝土矿的主要成分是氧化铝,根据题中流程图可知,在反应Ⅲ中通入二氧化碳,而流程最后要得到硫酸盐,所以为了除去杂质,先在铝土矿中加入过量的稀硫酸,得废渣a为SiO2,滤液中含有Al3+、Fe3+,所以X为稀硫酸,再加过量的氢氧化钠溶液,生成偏铝酸钠溶液和氢氧化铁沉淀,所以废渣b为氢氧化铁,Y为氢氧化钠,反应Ⅲ为偏铝酸钠溶液与过量二氧化碳反应生成氢氧化铝沉淀和废液,反应Ⅳ为氢氧化铝中加上硫酸可以制得Al2(SO4)3,反应Ⅵ中氨气与硫酸反应生成(NH4)2SO4,反应Ⅴ中(NH4)2SO4转化为铵明矾,电解硫酸和硫酸铵的混合溶液,在阴极上得氢气,阳极上得(NH4)2S2O8,反应ⅤⅡ为(NH4)2S2O8与水反应生成双氧水和NH4HSO4,
(1)由上述分析可知,废渣a为SiO2,名称为二氧化硅,废渣b为氢氧化铁,
故答案为:二氧化硅;氢氧化铁;
(2)根据上面的分析可知,流程图中X为稀硫酸,X的化学式为H2SO4,
故答案为:H2SO4;
(3)反应Ⅲ为偏铝酸钠溶液与过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,反应Ⅲ的离子方程式为 AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,铵明矾晶体中有结晶水,温度过高会使结晶水失去,所以从铵明矾溶液中获得铵明矾晶体的操作依次为 蒸发浓缩、冷却结晶、过滤、洗涤,
故答案为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;蒸发浓缩;
(4)根据电解原理阳极失电子发生氧化反应,SO42?失电子生成S2O82-,电极方程式为2SO42--2e-═S2O82-,
故答案为:2SO42--2e-═S2O82-;
(5)根据元素守恒和题中信息可知,反应Ⅶ的化学方程式为(NH4)2S2O8+2H2O=2NH4HSO4+H2O2,NH4HSO4溶液中电离出SO42-、H+、NH4+,其中铵根离子水解生成氢离子,所以溶液中离子浓度由大到小顺序为c(H+)>c(SO42-)>c(NH4+)>c(OH-),
故答案为:(NH4)2S2O8+2H2O=2NH4HSO4+H2O2;c(H+)>c(SO42-)>c(NH4+)>c(OH-);
(6)设NH4Al(SO4)2为2mol,逐滴加入氢氧化钡溶液,则;
A.如Al3+完全转化为AlO2-,则需要5molBa(OH)2,此时发生2NH4Al(SO4)2+5Ba(OH)2=2NH3•H2O+4BaSO4↓+Ba(AlO2)2+4H2O,则n(NH4Al(SO4)2):n(Ba(OH)2)<2时,生成产物为(NH4)2SO4、BaSO4↓、Al(OH)3,可能含有Al2(SO4)3,故A不选;
B.n(NH4Al(SO4)2):n(Ba(OH)2)=2时,生成产物为NH3•H2O、BaSO4和Al(OH)3,故B选;
C.设NH4Al(SO4)2为2mol,溶液中含有2molNH4+、2molAl3+、4molSO42-,Al3+完全沉淀时,需要3molBa(OH)2,此时发生2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓,故C不选;
D.如SO42-完全反应,则需要4molBa(OH)2,此时发生NH4Al(SO4)2+2Ba(OH)2=NH3•H2O+2BaSO4↓+Al(OH)3↓,故D不选;
故选B.
点评 本题考查制备实验方案的设计,为高频考点,侧重考查化学流程的分析、基本操作、电解原理、离子浓度比较、化学反应的判断,把握工艺流程及发生的反应、混合物分离提纯等为解答的关键,题目难度中等,需要学生具备阅读获取信息能力、综合运用知识、信息分析问题解决问题能力.

 名校课堂系列答案
名校课堂系列答案| A. | 开发太阳能、水能、风能、地热能等新能源 | |
| B. | 大力开采煤、石油和天然气,以满足人们日益增长的能源需求 | |
| C. | 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源 | |
| D. | 减少资源消耗,注重资源的重复使用、资源的循环再生 |
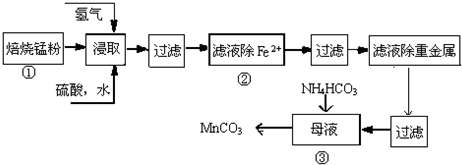
试回答下列问题:
(1)硫酸锌水溶液显酸性,用离子方程式说明Zn2++2H2O?Zn(OH)2+2H+.
(2)原料锰粉粗品中主要成分为MnO2和炭,在过程①焙烧时反应的化学方程式为MnO2+C═MnO+CO↑,该反应的氧化产物是CO,每生成44.8L(标准状况下)气体时转移电子数为4NA.
(3)在50~55℃时向过程③中MnSO4的母液中加入足量NH4HCO3,有气体生成,其化学方程式为:MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑.
(4)已知三种离子沉淀的pH范围为Fe3+:2.7~3.7. Mn2+:8.6~10.1,Fe2+:7.6~9.6.下表是上述过程②中除去Fe2+的模拟操作方法,请完成下表内容:
| 实验操作 | 离子方程式 |
| 步骤1:取少量滤液于试管中,加入过量酸化的H2O2溶液,振荡. | 2Fe2++H2O2+2H+=2Fe3++2H2O |
| 步骤2:将pH调到3.7~8.6,使Fe3+沉淀完全. | Fe3++3H2O?Fe(OH)3+3H+ |
| 编号 | 试剂 | 保存方法 | 理由 |
| A | 钠 | 存放在盛有煤油的细口瓶中 | 防止与O2会H2O反应 |
| B | 碳酸钠晶体 | 存放在干燥密闭的广口瓶中 | 防止风化而变质 |
| C | 新制氯水 | 存放在带橡皮塞的细口瓶中 | 防止挥发,防止瓶塞与瓶口粘连 |
| D | 固体氢氧化钠 | 存放在带橡皮塞的广口瓶中 | 防止接触空气被氧化,防止与水蒸气、二氧化碳接触而变质 |
| A. | A | B. | B | C. | C | D. | D |
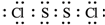 .
.