题目内容
9.一定温度下进行反应:COCl2(g)?Cl2(g)+CO(g),向2.0L恒容密闭容器中充入1.0mol COCl2(g),反应过程中测得的有关数据见下表:| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 0~4s容器内的压强逐渐增大 | |
| B. | 生成Cl2的平均反应速率,0~2s比2~4s快 | |
| C. | 8s时向容器中再充入一定量的氦气,反应速率又会加快 | |
| D. | 该条件下,COCl2的最大转化率为40% |
分析 A.6s时处于平衡状态,而4s时未到达平衡状态,0~4s内反应向正反应进行,容器内混合气体物质的量增大,恒温恒压下,压强之比等于气体物质的量之比;
B.根据表中数据可知,在0~2s中氯气变化了0.3mol,在2~4s中氯气变化了0.09mol,相同时间内生成氯气越多,反应速率越快;
C.8s时向容器中再充入一定量的氦气,恒温恒容下,反应混合物各组分浓度不变,反应速率不变;
D.平衡时生成氯气0.4mol,由方程式可知消耗COCl2的物质的量为0.4mol,COCl2转化率=$\frac{消耗COC{l}_{2}物质的量}{COC{l}_{2}起始物质的量}$×100%.
解答 解:A.6s时处于平衡状态,而4s时未到达平衡状态,0~4s内反应向正反应进行,容器内混合气体物质的量增大,恒温恒压下,压强之比等于气体物质的量之比,故0~4s容器内的压强逐渐增大,故A正确;
B.根据表中数据可知,在0~2s中氯气变化了0.3mol,在2~4s中氯气变化了0.09mol,相同时间内生成氯气越多,反应速率越快,所以生成Cl2的平均反应速率:0~2s比2~4s快,故B正确;
C.8s时向容器中再充入一定量的氦气,恒温恒容下,反应混合物各组分浓度不变,反应速率不变,故C错误;
D.平衡时生成氯气0.4mol,由方程式可知消耗COCl2的物质的量为0.4mol,COCl2转化率=$\frac{0.4mol}{1mol}$×100%=40%,故D正确,
故选:C.
点评 本题考查化学平衡计算、化学反应速率等知识,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
8.a g KNO3溶于b g水,形成V mL饱和溶液.下列关系式错误的是( )
| A. | KNO3物质的量浓度:c(KNO3)=$\frac{a}{101V}$mol•L-1 | |
| B. | 20℃时KNO3的溶解度S=$\frac{100a}{b}$ g | |
| C. | KNO3质量分数:w(KNO3)=$\frac{100a}{a+b}$% | |
| D. | 该溶液的密度ρ=$\frac{1000(a+b)}{V}$g•L-1 |
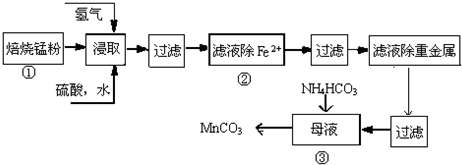
17.锌锰废电池可回收锌、锰元素生产硫酸锌及碳酸锰,其中生产碳酸锰的主要工艺如下:
试回答下列问题:
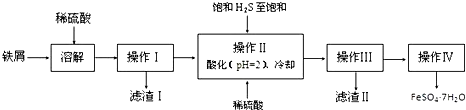
(1)硫酸锌水溶液显酸性,用离子方程式说明Zn2++2H2O?Zn(OH)2+2H+.
(2)原料锰粉粗品中主要成分为MnO2和炭,在过程①焙烧时反应的化学方程式为MnO2+C═MnO+CO↑,该反应的氧化产物是CO,每生成44.8L(标准状况下)气体时转移电子数为4NA.
(3)在50~55℃时向过程③中MnSO4的母液中加入足量NH4HCO3,有气体生成,其化学方程式为:MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑.
(4)已知三种离子沉淀的pH范围为Fe3+:2.7~3.7. Mn2+:8.6~10.1,Fe2+:7.6~9.6.下表是上述过程②中除去Fe2+的模拟操作方法,请完成下表内容:

试回答下列问题:
(1)硫酸锌水溶液显酸性,用离子方程式说明Zn2++2H2O?Zn(OH)2+2H+.
(2)原料锰粉粗品中主要成分为MnO2和炭,在过程①焙烧时反应的化学方程式为MnO2+C═MnO+CO↑,该反应的氧化产物是CO,每生成44.8L(标准状况下)气体时转移电子数为4NA.
(3)在50~55℃时向过程③中MnSO4的母液中加入足量NH4HCO3,有气体生成,其化学方程式为:MnSO4+2NH4HCO3=(NH4)2SO4+MnCO3↓+H2O+CO2↑.
(4)已知三种离子沉淀的pH范围为Fe3+:2.7~3.7. Mn2+:8.6~10.1,Fe2+:7.6~9.6.下表是上述过程②中除去Fe2+的模拟操作方法,请完成下表内容:
| 实验操作 | 离子方程式 |
| 步骤1:取少量滤液于试管中,加入过量酸化的H2O2溶液,振荡. | 2Fe2++H2O2+2H+=2Fe3++2H2O |
| 步骤2:将pH调到3.7~8.6,使Fe3+沉淀完全. | Fe3++3H2O?Fe(OH)3+3H+ |
14.700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).反应过程中测定的部分数据见下表(表中t1>t2),则下列说法正确的是( )
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=0.40/t1mol•L-1•min-1 | |
| B. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率减小 | |
| D. | 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol |
19.10.6g Na2CO3的物质的量是( )
| A. | 0.05 mol | B. | 1 mol | C. | 0.1 mol | D. | 0.2 mol |