��Ŀ����
��֪��Cu(OH)2�Ƕ�Ԫ��������ᣨH3PO3���Ƕ�Ԫ���ᣬ��NaOH��Һ��Ӧ������Na2HPO3��
��1����ͭ����Һ��Cu2������ˮ�ⷴӦ�����ӷ���ʽΪ____���÷�Ӧ��ƽ�ⳣ��Ϊ____������֪��25��ʱ��Ksp[Cu(OH)2]��2.0��10��20mol3/L3��
��2������H3PO3�����ʿ��Ʋ�Na2HPO3ϡ��Һ��pH______7��������������������������£���10mL0.01mol/L H3PO3��Һ�еμ�10ml0.02mol/LNaOH��Һ����Һ�и�������Ũ���ɴ�С��˳����_________��
��3�����Na2HPO3��Һ�ɵõ������ᣬװ����ͼ��˵������Ĥֻ����������ͨ������Ĥֻ����������ͨ����
�������ĵ缫��ӦʽΪ____________________��
�ڲ�Ʒ���з�Ӧ�����ӷ���ʽΪ____________��
��13�֣���1��Cu2+��2H2O Cu(OH)2��2H+��2�֣���5��10��9��2�֣�
Cu(OH)2��2H+��2�֣���5��10��9��2�֣�
��2������2�֣���c(Na+)��c(HPO32��)��c(OH��)��c(H2PO3��)��c(H+)��2�֣�
��3����4OH�D�D4e����2H2O��O2����2�֣�
��HPO32����2H����H3PO3��2�֣���HPO32����H����H2PO3����H2PO3����H����H3PO3����1�֣�
���������������1��������ͭ���������ͭ���ӿ���ˮ�⣬��Һ�����ԣ���ˮ�ⷴӦ�����ӷ���ʽΪCu2+��2H2O Cu(OH)2��2H+����ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ�����Ը÷�Ӧ��ƽ�ⳣ��K��
Cu(OH)2��2H+����ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ�����Ը÷�Ӧ��ƽ�ⳣ��K�� ��
��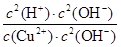 =
=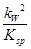 ��
��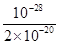 ��5��10��9��
��5��10��9��
��2��H3PO3�����ᣬNa2HPO3��ǿ�������Σ�����HPO32��ˮ�⣬��ˮ��Һ�ʼ��ԣ���pH��7����10mL0.01mol/LH3PO3��Һ�еμ�10ml 0.02mol/LNaOH��Һ����ǡ�÷�Ӧ����Na2HPO3����Һˮ���Լ��ԣ�������Һ������Ũ�ȴ�СΪc(Na+)��c(HPO32��)��c(OH��)��c(H2PO3��)��c(H+)��
��3���ٵ�������ʧȥ���ӣ�����������Ӧ�������õ����ӷ�����ԭ��Ӧ�����Ը���װ��ͼ��֪������������������ʧ���ӷ���������Ӧ���缫��ӦʽΪ4OH�D�D4e����2H2O��O2����
��������Ĥֻ����������ͨ������Ĥֻ����������ͨ�������Բ�Ʒ����HPO32���������ӽ�����������ᣬ��Ӧ���ӷ���ʽΪHPO32����2H����H3PO3����HPO32����H����H2PO3����H2PO3����H����H3PO3��
���㣺����ˮ�ⷽ��ʽ��ƽ�ⳣ�����㣻����к���Һ������Ũ�ȴ�С�Ƚϣ����ԭ����Ӧ���Լ��缫��Ӧʽ����д��

(1)ˮ�ĵ���ƽ��������ͼ��ʾ����A���ʾ25��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȣ�B���ʾ100��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȡ���100��ʱ1 mol��L��1��NaOH��Һ�У���ˮ�������c(H��)��___________mol��L��1��25 ��ʱ����ˮ�ĵ���ƽ����ϵ�м�������NH4Cl���壬��ˮ�ĵ���ƽ���Ӱ����________(��ٽ����������ơ���Ӱ�족)��
(2)����ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ����������֪������ݡ�
| ��ѧʽ | ����ƽ�ⳣ��(25��) |
| HCN | K��4.9��10��10 |
| CH3COOH | K��1.8��10��5 |
| H2CO3 | K1��4.3��10��7��K2��5.6��10��11 |
c(CH3COO��)(�����������������)��
��25��ʱ���е�Ũ�ȵĢ�NaCN��Һ����Na2CO3��Һ����CH3COONa��Һ��������Һ��pH�ɴ�С��˳��Ϊ___________��(�����)
����NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽΪ_________________________________��
������ǿ�ᣬ��ѧ�ν�������ˮ��Һ�п�����ȫ���롣����ʵ�ǣ�������ˮ�еĵ�һ����������ȫ�ģ��ڶ������벢����ȫ����������Ϊ:H2SO4=H++HSO4-��HSO4- H+ + S042-��
H+ + S042-��
��ش������й�����:
��1��Na2SO4��Һ��_(������ԡ��������ԡ��������ԡ�)����������_
(�����ӷ���ʽ��ʾ)��
��2��H2SO4��Һ��BaC12��Һ��Ӧ�����ӷ���ʽΪ_ ��
��3����0��l0mol��L-1��Na2SO4��Һ�У���������Ũ�ȹ�ϵ��ȷ����_ (��д���)��
| A��c(Na+)=c(SO42-)+c��HSO4һ)+c(H2SO4) |
| B��c(OH-)="c(" HSO4-)+c(H+) |
| C��c( Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) |
| D��c( Na+)=2c(SO42-)+2c(HSO4-) |
��5����25��ʱ��0��10 mol��L-1H2SO4��Һ��pH=-lg0��11����0��10 mol��L-1��H2SO4��Һ��c(SO42-)= mol��L-1
[14��]��֪��I2��2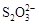

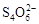 ��2I�D��������ʵ��ܶȻ��������±���
��2I�D��������ʵ��ܶȻ��������±���
| ���� | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2��10��20 | 2.6��10��39 | 1.7��10��7 | 1.3��10��12 |
���˺�������Һ����������Ũ���ᾧ���ɵõ�CuCl2?2H2O���塣
��2���ڿ�����ֱ�Ӽ���CuCl2?2H2O����ò���������ˮCuCl2��ԭ����_______________�����û�ѧ����ʽ��ʾ������CuCl2?2H2O����õ�������ˮCuCl2�ĺ���������_______��
��3��ijѧϰС���á���ӵ��������ⶨ����CuCl2?2H2O�������������������I�D������Ӧ�������������ʣ��Ĵ��ȣ��������£�ȡ0.36 g��������ˮ���������KI���壬��ַ�Ӧ�����ɰ�ɫ��������0.1000 mol/L Na2S2O3����Һ�ζ�������ζ��յ�ʱ������Na2S2O3����Һ20.00 mL��
�ٿ�ѡ��___________���ζ�ָʾ�����ζ��յ��������_________________��
��CuCl2��Һ��KI��Ӧ�����ӷ���ʽΪ______________________________��
�۸�������CuCl2?2H2O�������ٷ���Ϊ___________________________��
��12�֣�ijѧ����0.1000mol��L��1��NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷֽ�Ϊ���¼�����
A��ȡ25.00mL����������Һע��ྻ����ƿ�У�������2��3�η�̪��Һ
B�ñ�NaOH��Һ��ϴ�ζ���2��3��
C��ʢ�б�NaOH��Һ�ļ�ʽ�ζ��̶ܹ��ã���ѹ�����飬ʹ�ζ��ܼ��������Һ
Dȡ��NaOH��Һע���ʽ�ζ��ܵ���0���̶�����2��3cm
E������Һ������0����0���̶����£����¶���
F������ƿ���ڵζ��ܵ����棬�ñ�NaOH��Һ�ζ����յ㣬�����µζ���Һ��Ķ���
��1����ͼ�����ڼ�ʽ�ζ��ܵ� ��ѡ����ס������ҡ�����
��2����ȷ�IJ���˳���� ������ĸ��ţ���
��3������B��������Ŀ���� ��
��4���жϵ���ζ��յ��ʵ�������� ��
��5������A������֮ǰ�������ô�����Һ��ϴ��ƿ����Եζ������Ӱ���� ���ƫ��ƫС������Ӱ�족����
��6����ƽ��ʵ�����Σ���¼���������±�
| �ζ����� | ������Һ�����(/mL) | ��NaOH��Һ����� | |
| �ζ�ǰ����(/mL) | �ζ������(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
��CuO�ǽ���ҵ��ͭ����ͭ�Ͻ�ȸ��±��ն��ɵģ�������Ҫ�����������P��ɳ���Դ�CuOΪԭ���Ʊ���������Ҫ�������£�
��֪Fe3+��Fe2+ ��Cu2+ת��Ϊ��Ӧ��������ʱ����ʼ�����ͳ�����ȫʱ��pH���±���
| | Fe3+ | Fe2+ | Cu2+ |
| ��ʼ����ʱ��pH | 2.7 | 7.6 | 5.2 |
| ��ȫ����ʱ��pH | 3.7 | 9.6 | 6.4 |
��1������3% H2O2֮ǰ������в���������������� ��
H2O2�μӷ�Ӧ�����ӷ���ʽΪ ��
��2����ϡ��ˮ����pH��Ŀ���� ��pHӦ���� ��Χ���������ʿ��������ϡ��ˮ���� ��
��NaOH ��Fe2O3 ��CuO ��Na2CO3
��3����������õ��ֵ�����������õ����µ���������������ͬ��������� �� ��
���ˡ� ������Ȳ��衣
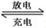 Fe��2NaCl,�õ�طŵ�ʱ��������ӦʽΪ ________________ _____��
Fe��2NaCl,�õ�طŵ�ʱ��������ӦʽΪ ________________ _____��
