��Ŀ����
��17�֣���ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�á�
��1��һ�������£�ģ��ij��ʯ�γɵķ�ӦaW+bQ��cN+dP+eR�õ�����ͼ��
�ٸ÷�Ӧ�ġ�H 0���>������=����<������
��ij�¶��£�ƽ�ⳣ������ʽΪK =c2��X��������ͼ��2���ж�X����������Ϊ____��
��2����E��F�����ܱ������У���һ�������·�����Ӧ��E��g��+F��s�� 2G��g��������
2G��g��������
���������ƽ��ʱG�����������%�����¶Ⱥ�ѹǿ�ı仯���±���ʾ��
��K��915�棩��K��810�棩�Ĺ�ϵΪK��915�棩____K��810�棩������ڡ��������ڡ���С�ڡ�����a��b��f���ߵĴ�С��ϵΪ ��1000�桢3��0 MPaʱE��ת����Ϊ____����3��25��ʱ��H2CO3 HCO3��+H+�ĵ��볣��Ka=4��10��7 mo1��L��1������¶��£�NaHCO3��ˮ�ⳣ��Kh= �������ʵ����Թ�ʵ��֤��Na2CO3��Һ�д���CO32��+H2O
HCO3��+H+�ĵ��볣��Ka=4��10��7 mo1��L��1������¶��£�NaHCO3��ˮ�ⳣ��Kh= �������ʵ����Թ�ʵ��֤��Na2CO3��Һ�д���CO32��+H2O  HCO3��+OH������ʵ ��
HCO3��+OH������ʵ ��
��1���٣�����R����2�����ڣ�f��a��b��69.5%����3��2.5��10��8��ȡ����̼������Һ�����Թ��У��μ��Ȼ�����Һ�а�ɫ�������ɣ�֤������̼�������ȡ����̼������Һ�����Թ��У��μӷ�̪��Һ��죬֤�������������ɡ�
���������������1���ٸ���ͼ��1��֪���÷�Ӧ��K�����¶ȵ����߶�������÷�Ӧ����Ϊ���ȷ�Ӧ����H��0���ڸ���ͼ��2��֪���÷�Ӧ�Ļ�ѧ����ʽΪ2W+Q��3N+P+2R��ij�¶��£�ƽ�ⳣ������ʽΪK =c2��X��������ƽ�ⳣ������ʽ����дԭ�����Һ�岻д��ƽ�ⳣ������ʽ������ͼ��2���ж�X����������ΪR��
��2����Ӧ��E��g��+F��s�� 2G��g������Ϊ���������С�ķ�Ӧ����ѹ��ƽ�������ƶ���G�����������%����С�����������ݷ���������Ϊѹǿ��ƽ��Ӱ������ݣ���54.0��a��b��c��75.0��d��e��f��82.0���ɵ�a��b��f���ߵĴ�С��ϵΪf��a��b��������������֪��e��c��54.0,������������Ϊ�¶ȶ�ƽ���Ӱ�죬���£�G�����������%������ƽ�������ƶ�����÷�Ӧ����Ϊ���ȷ�Ӧ����K��915�棩��K��810�棩�Ĺ�ϵΪK��915�棩����K��810�棩�������������֪��1000�桢3��0 MPaʱG�����������%��Ϊ82.0�����ݷ�Ӧ��E��g��+F��s��
2G��g������Ϊ���������С�ķ�Ӧ����ѹ��ƽ�������ƶ���G�����������%����С�����������ݷ���������Ϊѹǿ��ƽ��Ӱ������ݣ���54.0��a��b��c��75.0��d��e��f��82.0���ɵ�a��b��f���ߵĴ�С��ϵΪf��a��b��������������֪��e��c��54.0,������������Ϊ�¶ȶ�ƽ���Ӱ�죬���£�G�����������%������ƽ�������ƶ�����÷�Ӧ����Ϊ���ȷ�Ӧ����K��915�棩��K��810�棩�Ĺ�ϵΪK��915�棩����K��810�棩�������������֪��1000�桢3��0 MPaʱG�����������%��Ϊ82.0�����ݷ�Ӧ��E��g��+F��s�� 2G��g����������ʽ���㣬����ʼ�����E���ʵ���Ϊ1mol��ת����Ϊx��
2G��g����������ʽ���㣬����ʼ�����E���ʵ���Ϊ1mol��ת����Ϊx��
E��g��+F��s�� 2G��g��
2G��g��
��ʼ��mol����1 ���� 0
ת����mol����x 2x
ƽ�⣨mol����1��x 2x
��2x/1+x=82.0%�����x=0.695��E��ת����Ϊ69.5%��
��3��25��ʱ��H2CO3���볣��Ka=c(HCO3��)c(H��)/c(H2CO3)��NaHCO3��ˮ�ⳣ��Kh=c(H2CO3)c(OH��)/c(HCO3��)����Ka��Kh=Kw��Kh=Kw/Ka=10��14/4��10��7=2.5��10��8��֤��Na2CO3��Һ�д��� CO32��+H2O HCO3��+OH������ʵΪȡ����̼������Һ�����Թ��У��μ��Ȼ�����Һ�а�ɫ�������ɣ�֤������̼�������ȡ����̼������Һ�����Թ��У��μӷ�̪��Һ��죬֤�������������ɡ�
CO32��+H2O HCO3��+OH������ʵΪȡ����̼������Һ�����Թ��У��μ��Ȼ�����Һ�а�ɫ�������ɣ�֤������̼�������ȡ����̼������Һ�����Թ��У��μӷ�̪��Һ��죬֤�������������ɡ�
���㣺���黯ѧƽ��ͼ���ƽ����㣬��������Ի�ѧƽ���Ӱ�죬������ʵĵ���������ˮ��ƽ�⡣

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д����仯�����й㷺��Ӧ�ã���SO2���ʵ��о��Ǹ��л�ѧ��ѧ��һ����Ҫ���ݡ�
I���Ա��о���һ����Ҫ���о�������������ĵ��ʼ����ֻ����ﰴ���±���ʾ�ֳ�3 �飬���2��������M�Ļ�ѧʽ�� ��
| ��1�� | ��2�� | ��3�� |
| S (����) | SO2��H2SO3��M��NaHSO3 | SO3��H2SO4��Na2SO4��NaHSO4 |

��1������ʵ�鷽������������ʵ������ȡ����SO2���� ��
A��Na2SO3��Һ��HNO3 B��Na2SO3����Ũ����
C���������ڴ�����ȼ�� D��ͭ���ȵ�Ũ����
��2��װ��C�������dz�ȥ�����SO2����ֹ��Ⱦ��������֪��������������Һ����SO2�� �����У������õ�Na2SO3��NaHSO3�Ļ����Һ�������£���ҺpH��n(SO32��)��n(HSO3��)�仯��ϵ���±�
| n(SO32��)��n(HSO3��) | 91��9 | 1��1 | 9��91 |
| pH | 8.2 | 7.2 | 6.2 |
������Һ��n(SO32��)��n(HSO3��) =10��1ʱ����Һ������Ũ�ȹ�ϵ��ȷ���� ��
A��c(Na+)+ c(H+)= 2c(SO32��)+ c(HSO3��)+ c(OH��)
B��c(Na+)��c(HSO3��)��c(SO32��)��c(OH��)��c(H+)
C��c(Na+)��c(SO32��)��c(HSO3��)��c(OH��)��c(H+)
��3��������װ����ͨ�������SO2��Ϊ����֤A��SO2��Fe3+������������ԭ��Ӧ������ȡA�з�Ӧ�����Һ�ֳ����ݣ������������̽��ʵ�飬�������۲��������ǵ�̽�����̣���ѡ�Լ���KMnO4��Һ��KSCN��Һ��BaCl2��Һ��ϡ���ᡢϡ���ᡢϡ�� �ᡢBa(NO3)2��Һ�����Ƶ���ˮ��
| ��� | ʵ�鷽�� | ʵ������ | ���� |
| ������ | ����һ����Һ�м���KMnO4��Һ��Һ | �Ϻ�ɫ��ȥ | SO2��Fe3+��Ӧ������Fe2+ |
| ������ | ���ڶ�����Һ�м��� | | SO2��Fe3+��Ӧ������Fe2+ |
| ������ | ���ڶ�����Һ�м��� | | SO2��Fe3+��Ӧ������SO42�� |
���������ٵó��Ľ����Ƿ���� ��ԭ�� ��
���������Ƶķ������뷽���۾��������ҵõ���Ӧ���ۣ����㽫�������������
��4��װ��B���ܱ���Br���Ļ�ԭ������SO2�������� ��
������ǿ�ᣬ��ѧ�ν�������ˮ��Һ�п�����ȫ���롣����ʵ�ǣ�������ˮ�еĵ�һ����������ȫ�ģ��ڶ������벢����ȫ����������Ϊ:H2SO4=H++HSO4-��HSO4- H+ + S042-��
H+ + S042-��
��ش������й�����:
��1��Na2SO4��Һ��_(������ԡ��������ԡ��������ԡ�)����������_
(�����ӷ���ʽ��ʾ)��
��2��H2SO4��Һ��BaC12��Һ��Ӧ�����ӷ���ʽΪ_ ��
��3����0��l0mol��L-1��Na2SO4��Һ�У���������Ũ�ȹ�ϵ��ȷ����_ (��д���)��
| A��c(Na+)=c(SO42-)+c��HSO4һ)+c(H2SO4) |
| B��c(OH-)="c(" HSO4-)+c(H+) |
| C��c( Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) |
| D��c( Na+)=2c(SO42-)+2c(HSO4-) |
��5����25��ʱ��0��10 mol��L-1H2SO4��Һ��pH=-lg0��11����0��10 mol��L-1��H2SO4��Һ��c(SO42-)= mol��L-1
[14��]��֪��I2��2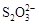

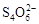 ��2I�D��������ʵ��ܶȻ��������±���
��2I�D��������ʵ��ܶȻ��������±���
| ���� | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2��10��20 | 2.6��10��39 | 1.7��10��7 | 1.3��10��12 |
���˺�������Һ����������Ũ���ᾧ���ɵõ�CuCl2?2H2O���塣
��2���ڿ�����ֱ�Ӽ���CuCl2?2H2O����ò���������ˮCuCl2��ԭ����_______________�����û�ѧ����ʽ��ʾ������CuCl2?2H2O����õ�������ˮCuCl2�ĺ���������_______��
��3��ijѧϰС���á���ӵ��������ⶨ����CuCl2?2H2O�������������������I�D������Ӧ�������������ʣ��Ĵ��ȣ��������£�ȡ0.36 g��������ˮ���������KI���壬��ַ�Ӧ�����ɰ�ɫ��������0.1000 mol/L Na2S2O3����Һ�ζ�������ζ��յ�ʱ������Na2S2O3����Һ20.00 mL��
�ٿ�ѡ��___________���ζ�ָʾ�����ζ��յ��������_________________��
��CuCl2��Һ��KI��Ӧ�����ӷ���ʽΪ______________________________��
�۸�������CuCl2?2H2O�������ٷ���Ϊ___________________________��
ij������ȤС�����ⶨijNaOH��Һ��Ũ�ȣ�������������£�
�ٽ���ʽ�ζ���������ˮϴ����������Һ��ϴ����ע�������Һ�����ڵζ��ܵļ��첿�ֳ�����Һ����ʹҺ�洦��"0"�̶����µ�λ�ã����¶���������ƿ������ˮϴ�����ô�����Һ��ϴ��ƿ2��3�Σ��Ӽ�ʽ�ζ����з���20.00mL������Һ����ƿ�С�
�ڽ���ʽ�ζ���������ˮϴ�������ñ���Һ��ϴ2-3�κ�������ע��0.1000 mol/L�����ᣬ���ڵζ��ܵļ��첿�ֳ�����Һ����ʹҺ�洦��"0"�̶����µ�λ�ã����¶�����
������ƿ�е����̪��ָʾ�������еζ����ζ���ָʾ���պñ�ɫ���Ұ��������ɫ���ٸı�Ϊֹ�����������������ΪV1mL��
���ظ����Ϲ��̣����ڵζ�����������ƿ����5mL������ˮ�����������������ΪV2 mL���Իش��������⣺
��1����ƿ�е���Һ�� ɫ��Ϊ�� �� ɫʱ��ֹͣ�ζ���
��2����С���ڲ�����еĴ����� ��
�ɴ���ɵIJⶨ��� (ƫ�ߡ�ƫ�ͻ���Ӱ��)��
��3����ͼ����ij�εζ�ʱ�ĵζ����е�Һ�棬�����Ϊ mL��
��4�������������ݣ�
| �ζ����� | ����Һ���(mL) | �����������mL�� | |
| �ζ�ǰ������mL�� | �ζ��������mL�� | ||
| ��һ�� | 20.00 | 0.50 | 22.60 |
| �ڶ��� | 20.00 | 1.00 | 24.50 |
| ������ | 20.00 | 2.10 | 24.00 |
���������ռ���Һ��Ũ��Ϊ ��
 H++OH? ����ش�
H++OH? ����ش� H+ + H2PO3����������������NaOH��Һ��Ӧ������Na2HPO3��
H+ + H2PO3����������������NaOH��Һ��Ӧ������Na2HPO3��
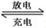 Fe��2NaCl,�õ�طŵ�ʱ��������ӦʽΪ ________________ _____��
Fe��2NaCl,�õ�طŵ�ʱ��������ӦʽΪ ________________ _____��
