题目内容
18.电子层数相同的三种元素X、Y、Z,已知其最高价氧化物对应水化物的酸性强弱为HXO4>H2YO4>H3ZO4.下列判断错误的是( )| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 原子半径:X>Y>Z | ||
| C. | 非金属性:X>Y>Z | D. | 单质氧化性:X>Y>Z |
分析 非金属性越强,最高价氧化物对应水化物的酸性越强,最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,同周期元素的原子从左到右,原子半径逐渐减小、元素非金属性增强、氢化物的稳定性逐渐增强、阴离子还原性减弱.
解答 解:非金属性越强,最高价氧化物对应水化物的酸性越强,最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,
A.非金属性越强,氢化物越稳定,由于非金属性X>Y>Z,所以气态氢化物的稳定性:HX>H2Y>ZH3,故A正确;
B.同周期从左到右非金属性增强,原子半径逐渐减小,所以原子半径:X<Y<Z,故B错误;
C.最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,故C正确;
D.非金属性X>Y>Z,元素的非金属性越强,对应的单质的氧化性越强,故D正确.
故选B.
点评 本题考查元素周期表与元素周期律的综合应用,题目难度中等,本题注意把握同周期元素性质的递变规律.也可以根据具体的元素氯、硫、磷解答.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
9.下列做法不能达到除杂目的是( )
| A. | 乙酸乙酯(乙酸):加饱和Na2CO3溶液,振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 乙酸(乙醇):加入金属钠,蒸馏 | |
| D. | 溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
6.下列实验操作、现象和结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | KIO3溶液中滴加HI,再滴加淀粉溶液 | 溶液出现蓝色 | KIO3氧化性比I2强 |
| B | 向Na2S溶液中滴加盐酸 | 产生气泡 | Cl的非金属性比S强 |
| C | 将一小块Na放入乙醇中 | 产生气泡 | 乙醇含有羟基 |
| D | 沿杯壁向水中加浓H2SO4,搅拌 | 烧杯外壁发烫 | 浓硫酸溶于水放热 |
| A. | A | B. | B | C. | C | D. | D |
3.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子序数:d>c>b>a | B. | 原子半径:r (A)>r (B)>r (D)>r (C) | ||
| C. | 单质的还原性:A>B>D>C | D. | 离子半径:r (C3-)>r (D-)>r (B+)>r (A2+) |
10.有机物分子中原子(或原子团)间的相互影响会导致化学性质的不同.下列叙述不能说明上述观点的是( )
| A. | 苯酚能与NaOH溶液反应,而乙醇不行 | |
| B. | 丙酮(CH3COCH3)分子中的氢比乙烷分子中的氢更易被卤原子取代 | |
| C. | 乙烯可发生加成反应,而乙烷不能 | |
| D. | 相等物质的量的甘油和乙醇分别与足量金属钠反应,甘油产生的H2多 |
7.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCl | CO2 | 石灰水 |
| ③ | CO2 | NH3 | Ca(Cl)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | SO2 | Ba(NO3)2 |
| A. | ②④ | B. | ①②④⑤ | C. | ①③④⑤ | D. | ①②③④ |
8.Ca(OH)2溶解度随温度变化画线如图所示,下列说法正确的是( )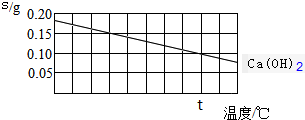

| A. | 氢氧化钙的溶解是吸热过程 | |
| B. | 温度升高时氢氧化钙溶解的速度减慢 | |
| C. | t℃时氢氧化钙的Ksp约等于2.46×10-4 | |
| D. | 向含有Ca(OH)2和Mg(OH)2两种沉淀的悬浊液中滴加NaOH浓溶液,分散系中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$的比值不变 |