题目内容
【题目】I.某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:(8分钟时A为0.2mol 、B为0.5mol)
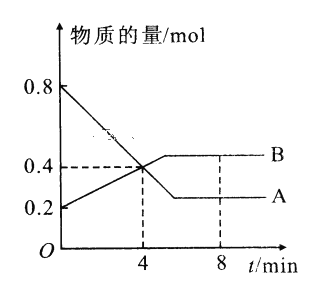
(1)该反应的化学方程式为_________________________。
(2)反应开始时至4min时,A的平均反应速率为________。
(3)4min时,反应是否达平衡状态?________(填“是”或“否”), 8min时,V正________V逆(填“>”“<”或“=”)。
II.在2L密闭容器中,800℃时反应2NO(g)+O2(g) →2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。
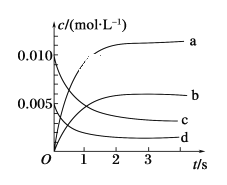
(3)能说明该反应已达到平衡状态的是________(填序号)。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c. v逆(NO)=2v正(O2) d. 容器内密度保持不变
【答案】2AB 0.05mol·(L·min)-1 否 = 是 b bc
【解析】
由图象可知,A为反应物,B为生成物,当A和B的物质的量保持不变时,反应达到平衡状态。由II 的表中数据可知,NO的物质的量在第3min后保持不变,达到平衡状态。
I.(1)由图象可知,在4min时,A和B的变化量分别为0.4mol和0.2mol,变化量之比为2:1,故该反应的化学方程式为2AB。
(2)反应开始时至4min时,A的平均反应速率为![]() 0.05mol·(L·min)-1。
0.05mol·(L·min)-1。
(3)4min时,反应没有达平衡状态,因为此后反应物和生成物的量仍在变化中。由图象中信息可知, 8min时,A和B的量保持不变,故反应处于平衡状态,故V正=V逆。
II.(1) 由II 的表中数据可知,NO的物质的量在第3min后保持不变,达到平衡状态。因此,上述反应是可逆反应。
(2)前3min,NO的浓度的变化量为![]() 0.0065mol/L,则该段时间内NO2的浓度的变化量也是0.0065mol/L,因此,结合图中信息可知,表示NO2变化曲线的是b。
0.0065mol/L,则该段时间内NO2的浓度的变化量也是0.0065mol/L,因此,结合图中信息可知,表示NO2变化曲线的是b。
(3) a. v(NO2) =2v(O2) ,不能表示正反应速率等于逆反应速率,不能说明该反应已达到平衡状态;
b. 反应前后的气体分子数不同,故当容器内压强保持不变时,能说明该反应已达到平衡状态;
c. v逆(NO)=2v正(O2) ,表示正反应速率等于逆反应速率,故能说明该反应已达到平衡状态;
d. 反应过程中容器内的气体的质量和体积一直保持不变,故当容器内密度保持不变时,不能说明该反应已达到平衡状态。
综上所述,能说明该反应已达到平衡状态的是bc。

【题目】2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是________(填元素符号)。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是________,其氢化物的电子式是_________。
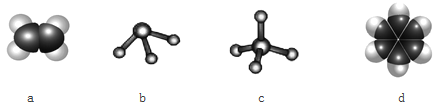
(3)元素①和②可以形成多种化合物。下图模型表示的分子中,不可能由①和②形成的是_______(填序号)。
(4)比较元素②、③的最高价氧化物对应水化物的酸性:______>______(填化学式)。说明你判断的理由:_________。
(5)主族元素砷(As)的部分信息如图所示。
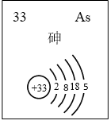
i.砷(As)在周期表中的位置是______。
ii.下列说法正确的是_______(填序号)。
a. 砷元素的最高化合价为+4
b. 推测砷有多种氧化物
c. ③的气态氢化物的还原性大于砷的气态氢化物的还原性
(6)某小组同学设计实验比较VIIA元素的非金属性:Cl>Br>I。
已知:常温下浓盐酸与高锰酸钾反应生成氯气。
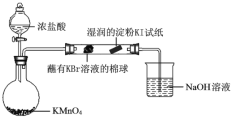
打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙红色,湿润的淀粉KI试纸变蓝,据此现象能否说明非金属性:Br > I,并说明理由_________。


