题目内容
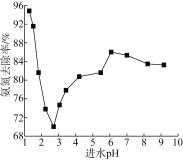
【题目】I 某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。
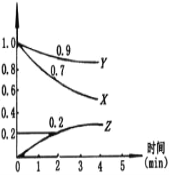
(1)由图中数据该反应的化学方程式为_________________。
(2)反应开始至2min,用Z表示的平均反应速率为________。用X表示的平均反应速率为___________________
II 对于可逆反应CO(g)+H2O (g) ![]() CO2(g)+H2 (g),若开始时容器中各有1mol的CO(g)和H2O (g),并在一定条件下发生反应,回答下面的问题:
CO2(g)+H2 (g),若开始时容器中各有1mol的CO(g)和H2O (g),并在一定条件下发生反应,回答下面的问题:
①恒温恒压时,向容器中充入0.5mol的He,这时反应速率___________(填“加快”、“减慢”或 “不变”),原因是____________________
②恒温恒容时,加入0.3mol的CO,这时反应速率___________(填“加快”、“减慢”或 “不变”),原因是_______________
【答案】3X+Y![]() 2Z 0.05mol·L-1·min-1 0.075 mol·L-1·min-1 减慢 恒温恒压时充入He,体系体积增大反应物浓度减小,反应速率减慢 加快 恒温恒容充入0.3molCO,反应物CO的浓度增大反应速率加快
2Z 0.05mol·L-1·min-1 0.075 mol·L-1·min-1 减慢 恒温恒压时充入He,体系体积增大反应物浓度减小,反应速率减慢 加快 恒温恒容充入0.3molCO,反应物CO的浓度增大反应速率加快
【解析】
I.(1)根据各物质的增减判断反应物、生成物,根据同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比判断;
(2)根据υ=![]() =
=![]() 计算;再根据同一反应、同一时间段内,各物质反应速率之比等于其计量数之比判断;
计算;再根据同一反应、同一时间段内,各物质反应速率之比等于其计量数之比判断;
II.①恒温恒压时,向容器中充入0.5mol的He,总体积增大,反应物浓度减小;
②恒温恒容时,加入0.3mol的CO,CO为反应物,且浓度增大。
I.(1)根据图象知,随着反应的进行,X、Y的物质的量减少,Z的物质的量增加,所以X、Y是反应物,Z是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,0~2min时,△n(X)=(1-0.7)mol=0.3mol,△n(Y)=(1-0.9)mol=0.1mol,△n(Z)=0.2mol-0=0.2mol,△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,故该反应的化学方程式为3X+Y![]() 2Z;
2Z;
(2)υ(Z)=![]() =
=![]() =
=![]() =0.05molL-1min-1;同一反应、同一时间段内,各物质反应速率之比等于其计量数之比,所以υ(Z):υ(X)=0.05molL-1min-1:υ(X)=2:3,υ(X)=0.075molL-1min-1;
=0.05molL-1min-1;同一反应、同一时间段内,各物质反应速率之比等于其计量数之比,所以υ(Z):υ(X)=0.05molL-1min-1:υ(X)=2:3,υ(X)=0.075molL-1min-1;
II.:①恒温恒压时,向容器中充入0.5mol的He,总体积增大,反应物浓度减小,则反应速率减慢;
②恒温恒容时,加入0.3mol的CO,CO为反应物,CO浓度增大,则反应速率加快。

 全优点练单元计划系列答案
全优点练单元计划系列答案