题目内容
【题目】下列描述中正确的是( )
A. HCl与NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热 △H=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热△H=+566.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 燃烧热是指1mol物质完全燃烧时放出的热量
【答案】B
【解析】
A.中和热是指酸和碱反应生成1mol水时放出的热量,其衡量标准是生成的水为1mol,稀溶液中强酸与强碱反应生成1mol水时的中和热为57.3kJ/mol,且稀H2SO4和Ca(OH)2反应生成的CaSO4微溶于水,故A错误;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,CO(g)的燃烧热是283.0kJ/mol,则CO燃烧热表示的热化学方程式为:CO(g)+![]() O2(g)═CO2 (g)△H=-283.0 kJ/mol;所以2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0kJ/mol,故B正确;
O2(g)═CO2 (g)△H=-283.0 kJ/mol;所以2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0kJ/mol,故B正确;
C.某些放热反应需要加热引发条件才能进行如铝热反应等,需要加热的反应不一定是吸热反应,故C错误;
D.燃烧热表示1mol可燃物完全燃烧生成稳定氧化物所释放的热量,故D错误;
故答案为B。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)
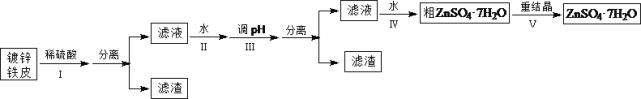
相关信息如下:①金属离子形成氢氧化物沉淀的相关pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Zn2+ | 5.4 | 8.2 |
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。
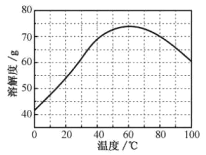
请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是_______________________________。②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是_______________________________。
(2)步骤Ⅱ,需加入过量H2O2,理由是_______________________________。
(3)步骤Ⅲ,合适的pH范围是_______________________________。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。请给出上述操作的正确顺序___________________(操作可重复使用)。
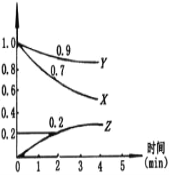
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如图1所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择_________方式进行冷却结晶。
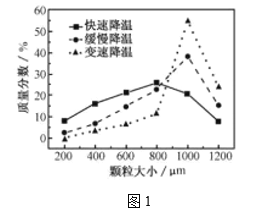
A.快速降温 B. 缓慢降温 C.变速降温
(6)ZnSO4·7H2O产品的纯度可用配位滴定法测定。
① 下列关于滴定分析,正确的是________________。
A.图2中,应将凡士林涂在旋塞的a端和旋塞套内的c端

B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
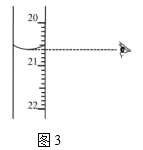
②图3中显示滴定终点时的度数是_____________mL。