题目内容
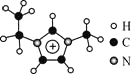
【题目】离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:
(1)碳原子价层电子的轨道表达式为__________,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是_______;NO3-与NO2-中O-N-O的键角:NO3-____ NO2-(填“<”、“>”“=”)。
(3)EMIM+离子与金属阳离子形成的离子化合物常温下呈液态的原因是____________。
(4)EMIM+离子中,碳原子的杂化轨道类型为___________。分子中的大π键可用符号πnm表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,则EMIM+离子中的大π键应表示为________。
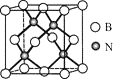
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于_______晶体,其中硼原子的配位数为_______。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为________(列出化简后的计算式)。
【答案】![]() 哑铃 NH3 > EMIM+离子为多核离子,其半径大,与金属阳离子作用的晶格能小,因而常温下为液体 sp2 、sp3 π56 原子 4
哑铃 NH3 > EMIM+离子为多核离子,其半径大,与金属阳离子作用的晶格能小,因而常温下为液体 sp2 、sp3 π56 原子 4 ![]()
【解析】
(1)碳元素为主族元素,价层电子是最外层电子数;核外电子占据最高能级是p能级,据此分析;
(2)根据价层电子对数=σ键+孤电子对数进行分析;
(3)离子化合物熔沸点受晶格能的影响,晶格能与半径、所带电荷数有关,据此分析;
(4)利用杂化轨道数等于价层电子对数,根据大π键的表示进行分析;
(5)根据晶体的性质进行分析,根据晶胞的结构,1个B原子连有4个N,即配位数为4,空间利用率=![]() ,进行分析;
,进行分析;
(1)碳原子排布式为1s22s22p2,碳原子价层电子数等于最外层电子数,其碳原子价层电子的轨道表达式为![]() ;最高能级为2p,形状为哑铃型或纺锤形;
;最高能级为2p,形状为哑铃型或纺锤形;
答案:![]() :哑铃型或纺锤形;
:哑铃型或纺锤形;
(2) 价层电子对数=σ键数+孤电子对数,则NH3、NO3-、NO2-中心原子的价层电子对分别为4、3、3,不同于其他两种粒子的是NH3,NO3-和NO2-中心原子均采用sp2杂化,NO3-中N不存在孤电子对,NO2-中N原子存在一对孤对电子,利用孤电子对数之间的斥力>孤电子对-成键电子对之间的斥力>成键电子对之间的斥力,因此NO2-中O-N-O的键角小于NO3-;
答案:NH3;>;
(3)离子化合物的熔沸点受晶格能的影响,晶格能与半径、所带电荷数有关,EMIM+离子为多核离子,其半径大,与金属阳离子作用的晶格能小,因而常温下为液体;
答案:EMIM+离子为多核离子,其半径大,与金属阳离子作用的晶格能小,因而常温下为液体;
(4)利用杂化轨道数等于价层电子对数,EMIM+离子中,碳原子的杂化轨道类型为sp2 、sp3,EMIM+离子中大π键的构成部分为: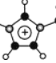 ,其中C、N原子均为sp2杂化,每个C原子提供1个电子,每个N原子提供2个电子,对外失去一个电子,大π键为π56;
,其中C、N原子均为sp2杂化,每个C原子提供1个电子,每个N原子提供2个电子,对外失去一个电子,大π键为π56;
答案:sp2 、sp3;π56;
(5)由于立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,这是原子晶体的特点,因此该晶体为原子晶体;根据晶胞,一个B与四个N原子相连,B的配位数为4;晶胞中原子的空间利用率=![]() ,根据晶胞,B原子的个数
,根据晶胞,B原子的个数![]() =4,N原子个数为4,原子的体积=
=4,N原子个数为4,原子的体积=![]() cm3,晶体的体积=
cm3,晶体的体积=![]() cm3,空间利用率为
cm3,空间利用率为![]() ;
;
答案:原子;4;![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案