题目内容
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)已知反应NO2(g)+CO(g)=NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是___。
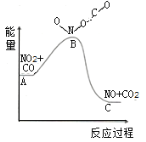
A.图中A→B的过程为放热过程
B.1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和
C.该反应为氧化还原反应
D.1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
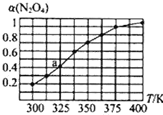
①由图推测该反应的△H___0(填“>”或“<”),理由为___。
②图中a点对应温度下,已知N2O4的起始压强为108kPa,则该温度下反应的平衡常数Kp=__kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
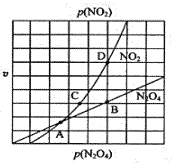
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=__。
(3)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
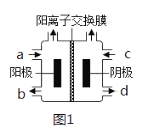
①收集到(CH3)4NOH的区域是___(填a、b、c或d)。
②写出电解池总反应(化学方程式)___。
【答案】C > 温度升高,α(N2O4)增加,说明平衡右移,该反应为吸热反应 115.2 0.5k2Kp d 2(CH3)4NCl+2H2O![]() 2(CH3)4NOH+H2↑+Cl2↑
2(CH3)4NOH+H2↑+Cl2↑
【解析】
(1)根据图像中反应物和生成物能量相对大小及氧化还原反应的特征分析解答;
(2)结合图像中转化率的变化运用勒夏特列原理分析解答;根据转化率运用三段式法计算平衡常数;根据平衡常数表达式及题干信息进行相关计算;
(3)电解过程中,阴极离子得电子被还原,生成氢氧根离子,所以收集到(CH3)4NOH的区域是阴极区;根据反应物与生成物的关系可知,电解过程中生成产物[(CH3)4NOH]、氢气和氯气,据此书写电解池总反应。
(1)A、由图象可知,图中A→B的过程为吸热过程,故错误;
B、该反应为放热反应,则放热反应反应物的键能总和小于生成物的键能总和,故错误;
C、反应前后氮元素和碳元素的化合价发生变化,则为氧化还原反应,故正确;
D、该反应为放热反应,放热反应反应物的总能量大于生成物的总能量,故错误;
故答案为C;
(2)①由图所示,随着温度升高,平衡转化率增大,说明温度升高平衡正反应方向移动,根据勒夏特列原理,该反应为吸热反应,所以△H>0,故答案为: > ;温度升高,α(N2O4)增加,说明平衡右移,该反应为吸热反应;
②由图像知,a点转化率为0.4,设起始时N2O4的物质的量为1mol,运用三段式法计算得:
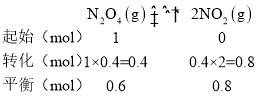
已知N2O4的起始压强为108kPa,则平衡时总压强为108kPa×![]() kPa
kPa
则 ,故答案为:115.2;
,故答案为:115.2;
③化学平衡常数![]() ,二者的反应速率之比等于其计量数之比,所以
,二者的反应速率之比等于其计量数之比,所以 ,即
,即![]() ,所以k1=0.5k2Kp,故答案为:0.5k2Kp;
,所以k1=0.5k2Kp,故答案为:0.5k2Kp;
(3)①以四甲基氯化铵[(CH3)4NCl]备四甲基氢氧化铵[(CH3)4NOH]需要氢氧根离子,在电解过程中,阴极离子得电子被还原,生成氢氧根离子,所以收集到(CH3)4NOH的区域是阴极区,即d区,故答案为:d;
②根据反应物与生成物的关系可知,电解过程中生成产物[(CH3)4NOH]、氢气和氯气,则电解池总反应为:2(CH3)4NCl+2H2O![]() 2(CH3)4NOH+H2↑+Cl2↑, 故答案为:2(CH3)4NCl+2H2O
2(CH3)4NOH+H2↑+Cl2↑, 故答案为:2(CH3)4NCl+2H2O![]() 2(CH3)4NOH+H2↑+Cl2↑。
2(CH3)4NOH+H2↑+Cl2↑。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】过氧乙酸(![]() ),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
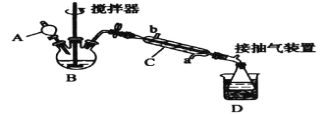
①在三颈烧瓶中加入一定量冰醋酸与浓硫酸的混合物,再缓缓加入适量30%的双氧水;
②不断搅拌并控制装置B中混合液的温度为20~30℃至反应结束;
③接入仪器C和抽气泵,在锥形瓶中收集得到产品。
回答下列问题:
(1)仪器C的名称是____,仪器C中冷水流入口是____(填“a”或“b”)。
(2)为更好地控制反应温度,应采用的加热方法是_____。
(3)生成过氧乙酸的化学方程式为____。
(4)实验测得产物过氧乙酸的百分含量随反应物比例和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例(CH3COOH/H2O2)是_____,最佳反应时间约_____。
反应物比例CH3COOH/H2O2 | 反应时间 | ||||
0.5h | 1h | 3h | 5h | 7h | |
2:1 | 7.38% | 8.46% | 9.42% | 11.26% | 13.48% |
1:1 | 0.56% | 12.92% | 13.54% | 20.72% | 20.80% |
1:2 | 6.14% | 7.10% | 7.96% | 10.38% | 12.36% |
(5)产品中过氧乙酸浓度的测定:取2.00mL过氧乙酸产品试样,加水稀释成100mL;从中取出5.00mL,逐滴滴加酸性KMnO4溶液至溶液恰好呈粉红色,以除去残余的H2O2;再加入稍过量的KI溶液,发生反应CH3COOOH+2I-+2H+=I2+CH3COOH+H2O;反应完全后,滴入几滴淀粉溶液,用0.1000mol·L-1的Na2S2O3标准液滴定至终点(反应式为2S2O32-+I2=S4O62-+2I-