题目内容
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。继续失去第二个电子所需能量称第二电离能。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。回答下列问题: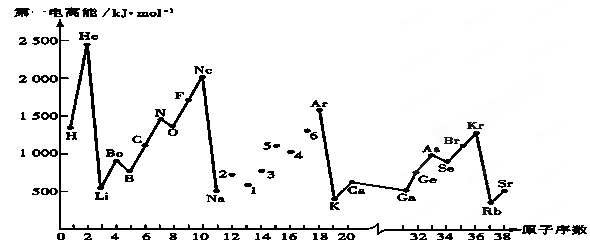
(1)同一周期元素的第一电离能从左到右总趋势是 (填增大、减小或不变,下同);同一主族元素原子从上到下的第一电离能I1变化规律是______________;稀有气体的第一电离能在同周期中是最大的,原因是______________________________________________________________________。
(2)认真分析上图中同周期元素第一电离能的变化规律,发现有一些反常,第一电离能 IIA>IIIA,VA>VIA: 如I1(铍)>I1(硼),2号大于1号,I1(氮)>I1(氧),5号大于4号。可能原因是 。(3)已知2号的I1=738KJ/mol, 则它的I2 738KJ/mol, I3 3×738KJ/mol;(填>、<、=)(4)已知5号和6号元素的电负性分别为2.1和3.0,则4号元素的电负性可能为( )
| A.3.5 | B.1.8 | C.2.5 | D.4.0 |
(每空1分,共9分)(1)增大;减小;已达稳定结构,不易失去电子
(2)第ⅡA族元素原子的ns轨道上电子排布达到全充满,第ⅤA族的p轨道半充满,是较稳定结构,难失去电子。而ⅢA族原子价电子排成ns2np1,若失去p能级的一个电子使剩余ns上达到全充满的较稳定结构,故I1较小 (3)>;> (4)C
(5)HClO4>H2SO4>H3PO4;上一周期的元素的氢化物分别为NH3、H2O、HF,半径小,键长小,键能大,分子稳定
解析试题分析:(1)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量,因此金属性越强第一电离能越小。同周期自左向右金属性逐渐减弱,非金属性逐渐增强,所以同一周期元素的第一电离能从左到右总趋势是增大;同主族自上而下金属性逐渐增强,非金属性逐渐减弱,则同一主族元素原子从上到下的第一电离能I1变化规律是逐渐减小;由于稀有气体元素的最外层电子已达稳定结构,不易失去电子,所以稀有气体的第一电离能在同周期中是最大。
(2)由于第ⅡA族元素原子的ns轨道上电子排布达到全充满状态,第ⅤA族的p轨道电子处于半充满状态,是较稳定结构,难失去电子。而ⅢA族原子价电子排成ns2np1,因此若失去p能级的一个电子使剩余ns上达到全充满的较稳定结构,故I1较小。
(3)由于镁元素的3s能级处于全充满状态,稳定性强,因此镁的第一电离能强于钠的,则2号元素是Mg。由于Mg失去最外层1个电子后使3s能级电子处于半充满状态,稳定性强,因此如果Mg元素的的I1=738KJ/mol,则它的I2>738KJ/mol。同样分析可知如果镁失去3s能级的2个电子后使2p能级的电子处于全充满状态,稳定性强,因此I3>3×738KJ/mol;
(4)由于P元素的3p能级处于半充满状态,稳定性强,因此P元素的第一电离能强于S元素的第一电离能,所以5、4、6三种元素分别是P、S、Cl。由于非金属性越强,电负性越大,所以S元素的电负性介于P和Cl元素之间,故答案选C。
(5)根据(OH)mROn可知n值越大,含氧酸的酸性越强,所以酸性强弱顺序是HClO4>H2SO4>H3PO4。由于上一周期的元素的氢化物分别为NH3、H2O、HF,半径小,键长小,键能大,分子稳定,因此它们的气态氢化物的稳定性均比同主族上一周期的元素气态氢化物弱。
考点:考查电离能、电负性、含氧酸酸性以及氢化物稳定性判断

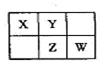
短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素的主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
(1)XY2的电子式是 ;Z2Y2中所含化学键类型是 ;XY2与Z2Y2反应的化学方程式是 。
(2)恒容条件下,一定量的NY2、Y2发生反应:2NY2(g)+Y2(g)
 2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图。该反应的△H 0(填“>”、“<”或“=”,下同);若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1 K2。
2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图。该反应的△H 0(填“>”、“<”或“=”,下同);若T1、T2时该反应的化学平衡常数分别为K1、K2,则K1 K2。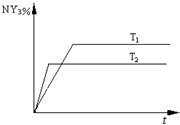
(3)X的非金属性比M (填“强”或“弱”),能证明此结论的事实是 (用离子方程式表示)。