题目内容
(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
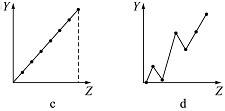
①ⅡA族元素的价电子数__________。
②第三周期元素的最高正价__________。
③F-、Na+、Mg2+、Al3+的离子半径__________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
①化合物XN的化学式为________。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液均呈碱性,组成元素的原子数目之比均为1∶1∶1,B是家庭“84”消毒液的有效成份。则化合物A中的化学键类型为__________,B的化学式为 。
③工业上制取单质M的化学方程式为 。
(1)①b(1分) ②c(1分) ③a(1分)
(2)①HCl(1分) ②离子键、(极性)共价键(2分) NaClO(2分)
③SiO2+2C Si+2CO↑(2分)
Si+2CO↑(2分)
解析试题分析:(1)①因同一主族元素的最外层电子数相等,故选b;②因元素的最高正价=最外层电子数=族序数,同一周期元素的最高化合价逐渐增大,故选c;③核外电子数相同,则核内质子数越多半径越小,所以离子半径为:O2–>F–>Na+>Mg2+>Al3+,故选a。(2)Y元素原子最外层电子数与核外电子总数之比为3:4,则最外层电子数为6,核外电子总数为8,故Y为O;M元素原子的最外层电子数与电子层数之比为4:3,则电子层数为3,最外层电子数为4,故M为Si;N-、Z+、X+离子的半径逐渐减小,且N的原子充数比M大,则N为氯,Z为钠;化合物XN常温下为气体,且X的原子充数最小,则X为氢。①XN为氯化氢,化学式为HCl;②由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液均呈碱性,组成元素的原子数目之比为1:1:1,满足条件的A物质应为NaOH,所以化合物A中既含有离子键又含有共价键,“84”消毒液的有效成份是次氯酸钠,所以B的化学式为NaClO,③工业上用焦炭高温下还原二氧化硅来制备硅,化学方程式为:SiO2+2C Si+2CO↑
Si+2CO↑
考点:考查原子结构与元素的性质、化学键、无机物的推断。

 高中必刷题系列答案
高中必刷题系列答案自然界中的水要经过消毒杀菌才可成为生活饮用水。ClO2是一种高效安全灭菌消毒剂,
其中Cl化合价为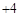 价。
价。
(1)氯原子最外层有 种能量不同的电子,某化合物中O的化合价与ClO2中O的化合价恰好相反,写出该化合物的分子式 。
(2)下列可用作比较S和C非金属性强弱依据的是
A.CS2中各元素的化合价 B.气态氢化物的稳定性
C.元素在周期表中的位置 D.最高价含氧酸的酸性
(3)以下性质的比较正确的是
A.键长:HF>HCl B.稳定性:HF>HCl
C.酸性:HF>HCl D.沸点:HF>HCl
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应① O3 O2 +[O]-Q 平衡常数为K1 ;
O2 +[O]-Q 平衡常数为K1 ;
反应② [O]+O3 2O2+Q 平衡常数为K2 ;
2O2+Q 平衡常数为K2 ;
总反应:2O3 3O2+Q 平衡常数为K。
3O2+Q 平衡常数为K。
(4)一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
已知:O3的起始浓度为0.0216 mol/L。
| pH t / min T / ℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
在30°C、pH=4.0条件下,O3的分解速率为_______________ mol/ (L·min)。
(5)根据表中数据,推测O3在下列条件下分解速率由小到大的顺序为________。(填字母代号)
A.40°C、pH=3.0 B.10°C、pH=4.0 C.30°C、pH=7.0
(6)下列叙述正确的是
A.降低温度,K增大 B.K=K1+K2
C.适当升温,可提高消毒效率 D.压强增大,K2减小
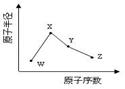
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。继续失去第二个电子所需能量称第二电离能。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。回答下列问题:
(1)同一周期元素的第一电离能从左到右总趋势是 (填增大、减小或不变,下同);同一主族元素原子从上到下的第一电离能I1变化规律是______________;稀有气体的第一电离能在同周期中是最大的,原因是______________________________________________________________________。
(2)认真分析上图中同周期元素第一电离能的变化规律,发现有一些反常,第一电离能 IIA>IIIA,VA>VIA: 如I1(铍)>I1(硼),2号大于1号,I1(氮)>I1(氧),5号大于4号。可能原因是 。(3)已知2号的I1=738KJ/mol, 则它的I2 738KJ/mol, I3 3×738KJ/mol;(填>、<、=)(4)已知5号和6号元素的电负性分别为2.1和3.0,则4号元素的电负性可能为( )
| A.3.5 | B.1.8 | C.2.5 | D.4.0 |
 2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。