题目内容
【题目】元素周期表中,除了22种非金属元素外,其余的都是金属,请根据元素周期表回答下列问题:
I.(1)基态氮原子核外共有_______种运动状态不相同的电子,该原子核外电子排布中电子在能量最低的轨道呈_______形,用n表示能层,氟元素所在族的外围电子排布式为______________。
(2)在元素周期表中,某些主族元素与下方的主族元素的性质有些相似,被称为“对角线规则”,如下表:

根据“对角线规则”写出Be(OH)2与NaOH反应的离子方程式______________,硼酸(H3BO3)是一种具有片层结构的白色晶体,层内的H3BO3分子间通过氢键相连(如图)。含1mol H3BO3的晶体中有__________mol氢键,H3BO3中B原子的杂化类型为_____________。

(3)以第二周期为例,除Be、N外,其它元素的第一电离能从左到右逐渐增大的原因是____________________________________________________。
II.近年来铁及其化合物在工农业中有广阔的应用前景。
(4)铁的一种络离子[Fe(CN)6]4-中Fe2+的配位数为6,该络离子中不存在______(填序号)。
A.共价键 B.非极性键 C.配位键 D.δ键 E.π键
(5)AlCl3的熔点比NaCl熔点低的原因是____________________________________。
(6)一种Al-Fe合金的立体晶胞如图所示。若晶体的密度为ρ gcm-3,则此合金中最近的两个Fe原子之间的距离为__________cm(用含ρ的代数式表示)。

【答案】 7 球形 ns2np5 Be(OH)2+2OH-=BeO22-+2H2O 3 sp2 从左到右,随着核电荷数增加,原子半径逐渐减小,原子核对外层价电子的吸引能力逐渐增大,故元素的第一电离能从左到右逐渐增大 B AlCl3是分子晶体,NaCl是离子晶体 ![]()
【解析】Ⅰ.(1)基态氮原子核外7个电子,每个电子运动状态不同,共有7种运动状态不相同的电子,该原子核外电子排布中电子在能量最低的轨道1s,呈球形型,用n表示能层,F元素所在族的外围电子排布式为ns2np5。(2)Be(OH)2和氢氧化铝一样,具有两性,能溶于强碱,Be(OH)2+ 2OH- = BeO22-+2H2O;每个硼酸分子有6个氢键,每个氢键两个硼酸共同拥的一个氢键,含1mol H3BO3的晶体中有3mol氢键,H3BO3中B原子形成3个δ键,无孤电子对,杂化类型为sp2 ;(3)以第二周期为例,除Be、N外,其它元素的第一电离能从左到右逐渐增大的原因是从左到右,随着核电荷数增加,原子半径逐渐减小,原子核对外层价电子的吸引能力逐渐增大,故元素的第一电离能从左到右逐渐增大;(4)[Fe(CN)6]4-中存在A.共价键,如C-N键;C.配位键,如中心原子与CN-间;D.σ键,如C-N键; E. π键,如碳氮叁键;由于没有相同原子形成的共价键,不存在 B.非极性键;故选B。(5)AlCl3的熔点比NaCl熔点低的原因是:AlCl3是分子晶体,NaCl是离子晶体;一个晶胞中含有8个Fe原子和4个Al原子,晶胞的质量为(56×8+27×4)/NAg, 棱长为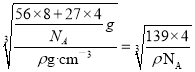 cm,个最近的2个Fe原子之间的距离为。
cm,个最近的2个Fe原子之间的距离为。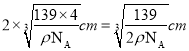

 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案