题目内容
17.在某温度下,NaOH的溶解度为20克,该温度下将40克NaOH放入110克水中,充分搅拌后,测的溶液的密度为1.2g/mL,则溶液中溶质的物质的量浓度为( )| A. | 5.0mol/L | B. | 0.02mol/L | C. | 2.0mol/L | D. | 0.8mol/L |
分析 首先根据溶解度判断40gNaOH是否完全溶解在110g水中,据此可知溶液质量,然后根据V=$\frac{m}{ρ}$计算溶液的体积,根据c=$\frac{n}{V}$计算溶液的物质的量浓度.
解答 解:已知在某温度下,NaOH的溶解度为20g,设110g水溶解xgNaOH,
则有:$\frac{20}{100}$=$\frac{x}{110}$
解得:x=22,
说明NaOH没有完全溶解,则溶液的质量为:110g+22g=132g,溶质的质量为22g,
所以溶质的物质的量为:$\frac{22g}{40g/mol}$=0.55mol,
溶液的体积为:$\frac{132g}{1.2g/mL}$=110mL=0.11L,
所以该溶液中溶质的物质的量浓度为:c=$\frac{0.55mol}{0.11}$=5mol/L,
故选A.
点评 本题考查物质的量浓度的计算,题目难度中等,根据氢氧化钠的溶解度判断40gNaOH是否完全溶解在110g水中为解答该题的关键,注意掌握物质的量浓度的概念及计算方法.

练习册系列答案
相关题目
7.在一定条件下,向某密闭容器中投入一定量的氮气和氢气,发生反应N2(g)+3H2(g)?2NH3(g).下列关于从反应开始至达到化学平衡的过程中正、逆反应速率变化情况的图象中,正确的是( )
| A. | 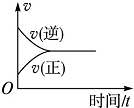 | B. | 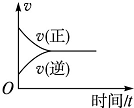 | C. | 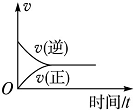 | D. | 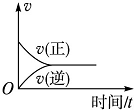 |
5.下列有关材料的说法正确的是( )
| A. | 金刚石因其硬度大和熔点高,所以人们目前还不能进行人工合成 | |
| B. | 无机非金属材料、金属材料和高分子材料都是我们生活和生产中不可缺少的材料,但高分子材料的共同特点是熔点低、硬度小,因此不耐高温 | |
| C. | 钛合金是新兴的形状记忆合金,将它置于人的大脑可以增强记忆功能 | |
| D. | 金属腐蚀会带来严重的危害和损失,但也可被用来进行材料加工 |
12.下列反应的离子方程式书写不正确的是( )
| A. | Ba(OH)2溶液与CuSO4溶液反应:Ba2++SO42-=BaSO4↓ | |
| B. | NaOH溶液与稀硫酸的反应:OH-+H+=H2O | |
| C. | NaHCO3溶液与盐酸的反应:HCO3-+H+=H2O+CO2↑ | |
| D. | KCl溶液与AgNO3溶液的反应:Cl-+Ag+=AgCl↓ |
2.下列离子方程式中正确的是( )
| A. | Cu(OH)2与盐酸反应:H++OH-=H2O | |
| B. | 氨气通入醋酸溶液中:NH3+CH3COOH=CH3COO-+NH4+ | |
| C. | MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ | |
| D. | CaCO3与稀盐酸反应:CO32-+2H+=H2CO3 |
9.下列有关实验操作错误的是( )
| A. | 用药匙取用粉末状或颗粒状固体 | B. | 用胶头滴管滴加少量液体 | ||
| C. | 倾倒液体时试剂瓶标签面向手心 | D. | 给盛有$\frac{2}{3}$体积液体的试管加热 |
11.下列排列顺序正确的是( )
| A. | 原子序数:C>Li>B | B. | 元素的非金属性:N>O>F | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 氢化物的稳定性:HF>HCl>HBr |
 .
.