题目内容
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间:
序号 | 反应 温度/℃ | c(H2O2)/ molL﹣1 | V(H2O2) /mL | m(MnO2) /g | t/min | |||||||
1 | 20 | 2 | 10 | 0 | t1 | |||||||
2 | 20 | 2 | 10 | 0.1 | t2 | |||||||
3 | 20 | 4 | 10 | 0.1 | t3 | |||||||
4 | 40 | 2 | 10 | 0.1 | t4 | |||||||
(1)设计实验2和实验3的目的是研究 对化学反应速率的影响;
(2)为研究温度对化学反应速率的影响,可以将实验 和实验 作对比(填序号);
(3)将实验1和实验2作对比,t1 t2(填“>”、“<”或“=”)。
Ⅱ.以KI和FeCl3反应为例(2Fe3++2![]() 2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1mol![]() KI溶液
KI溶液
②0.1mol![]() FeCl3溶液
FeCl3溶液
③0.1mol![]() FeCl2溶液
FeCl2溶液
④0.1mol![]() 盐酸
盐酸
⑤0.1mol![]() KSCN溶液
KSCN溶液
⑥CCl4
实验步骤:(1)取5mL 0.1mol![]() KI溶液,再滴加几滴0.1mol
KI溶液,再滴加几滴0.1mol![]() FeCl3溶液;
FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂 (填序号),现象 ,说明此反应存在一定的限度。
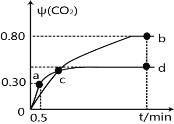
Ⅲ.N2O4可分解为NO2。在100mL密闭容器中投入0.01mol N2O4,利用现代化学实验技术跟踪测量c(NO2)。c(NO2)随时间变化的数据记录如图所示:
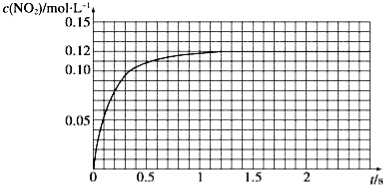
(1)反应容器中最后剩余的物质有 ,其中N2O4的物质的量为 mol;
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后 。(选填“变大”,“变小”或“不变”)
【答案】Ⅰ.(1)H2O2的浓度(2)2;4;(3)> Ⅱ.⑤;溶液出现血红色;
Ⅲ.(1)NO2、N2O4;(1分)0.004mol;(1分)(2)不变
【解析】
试题分析::Ⅰ.(1)根据表中数据可知实验1和实验2主要是双氧水浓度不同,则实验目的为实验2和实验3是研究双氧水浓度不同,对化学反应速率的影响;
(2)要研究温度对反应速率的影响,则其它条件必须是相同的,根据表中数据可知实验2和实验4其他条件都相同,只有温度不同;
(3)实验1和实验2相比较不同点是实验2使用了催化剂,催化剂能加快反应速率,则实验2的反应速率大,所用时间短;
Ⅱ.(4)另取KI和FeCl3反应后的溶液,加入0.1molL-1 KSCN溶液,如果溶液出现血红色,说明溶液中有没反应的FeCl3溶液,说明此反应为可逆反应;
Ⅲ.(1)因为N2O4(g)![]() 2NO2为可逆反应,反应达平衡时,反应容器中最后剩余的物质有NO2、N2O4;平衡时,n(NO2)=0.12mol/L×0.1L=0.012mol,则N2O4的物质的量为0.01mol-0.012mol/2=0.004mol;(2)反应达到平衡状态以后反应速率不再发生变化。
2NO2为可逆反应,反应达平衡时,反应容器中最后剩余的物质有NO2、N2O4;平衡时,n(NO2)=0.12mol/L×0.1L=0.012mol,则N2O4的物质的量为0.01mol-0.012mol/2=0.004mol;(2)反应达到平衡状态以后反应速率不再发生变化。

【题目】(14分)下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为 。
(2)表中元素原子半径最大的是(写元素符号) 。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是 。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为 。Q与水反应的化学方程式为 。
(5)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式 。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为 ,生成硫酸铜物质的量为 。