题目内容
【题目】Ⅰ如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
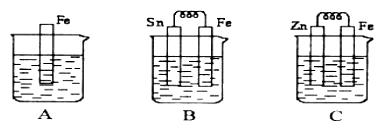
(1)B中Sn极上出现的现象________________;
(2)C中Zn片上的电极反应式为____________________;
(3)A、B、C中铁溶解的速率由快到慢的顺序是_______________。
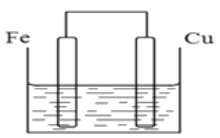
Ⅱ(4)若将质量相等的铁片和铜片用导线相连浸入硫酸铜溶液中构成原电池,如图,一段时间后,两电极质量相差1.2g,则导线中通过的电子的物质的量为_______________。
Ⅲ下图是一个化学过程的示意图,回答下列问题:
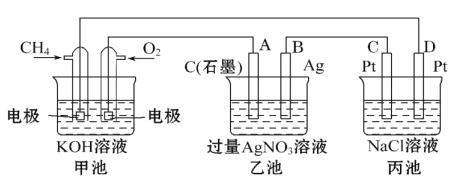
(5)甲装置中通入CH4的电极反应式为_____________________,
(6)从能量转化的角度分析,乙池是_____转化为_________的装置。
(7 )一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的物质的量浓度为________________。(己知:NaCl溶液足量,电解后溶液体积为500 mL)。
(8)若要使丙池恢复电解前的状态,应向丙池中通入_______(写化学式)。
【答案】(1)产生气泡(1分)
(2)Zn -2e-= Zn2+(1分)
(3)B>A>C(1分)
(4)0.02mol (2分)
(5)CH4+ 10OH- -8e- = CO32- +7H2O (2分)
(6)电能化学能(1分)
(7)0.01mol/L(2分)
(8)HCl(1分)
【解析】
试题分析:(1)B中金属活动性Fe>Sn,所以Fe、Sn及硫酸构成原电池,Sn是原电池的正极,在Sn极上发生反应:2H++2e-=H2↑,所以出现的现象产生气泡。
(2)C中金属活动性Zn>Fe,所以Zn片为原电池的负极,Zn片发生氧化反应,电极反应式为Zn -2e-= Zn2+;
(3)A中没有形成原电池,B中Fe为原电池的负极,溶解速率比A大,C中铁为原电池的正极,发生速率比A慢,所以三个烧杯中铁溶解的速率由快到慢的顺序是B>A>C;
(4)若将质量相等的铁片和铜片用导线相连浸入硫酸铜溶液中构成原电池,Fe为负极,发生反应:Fe-2e-=Fe2+,Cu片为正极,发生反应:Cu2++2e-=Cu,每有2mol电子转移,负极减轻56g,正极质量增加64g。两个电极质量差值是56g+64g=120g,现在是一段时间后,两电极质量相差1.2g,则电子转移的物质的量是n(e-)=(1.2g÷120g)×2mol=0.02mol;
(5)甲装置中通入CH4的电极是负极,发生氧化反应,负极的电极反应式为 CH4+ 10OH- -8e- = CO32- +7H2O;
(6)从能量转化的角度分析,乙池是与电源连接的装置,是电解池,是电能化学能的装置;
(7)丙池的电解饱和食盐水,在阳极发生反应:2Cl--2e-=Cl2↑,在阴极发生反应:2H++2e-=H2↑。总反应方程式是:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,可见,若产生2mol气体,溶液中同时产生2molNaOH, 一段时间,当丙池中产生112 mL(标准状况下)气体时,n(气体)=0.112L÷22.4L/mol=0.005mol, 则溶液中n(NaOH)= 0.005mol,c(NaOH)= 0.005mol÷0.5L= 0.01mol/L;
Cl2↑+H2↑+2NaOH,可见,若产生2mol气体,溶液中同时产生2molNaOH, 一段时间,当丙池中产生112 mL(标准状况下)气体时,n(气体)=0.112L÷22.4L/mol=0.005mol, 则溶液中n(NaOH)= 0.005mol,c(NaOH)= 0.005mol÷0.5L= 0.01mol/L;
(8)由于丙装置两个电极分别产生氢气、氯气,所以若要使丙池恢复电解前的状态,应向丙池中通入两个电极反应产生的气体发生化合反应产生的HCl气体,物质的量是0.005mol。

【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间:
序号 | 反应 温度/℃ | c(H2O2)/ molL﹣1 | V(H2O2) /mL | m(MnO2) /g | t/min | |||||||
1 | 20 | 2 | 10 | 0 | t1 | |||||||
2 | 20 | 2 | 10 | 0.1 | t2 | |||||||
3 | 20 | 4 | 10 | 0.1 | t3 | |||||||
4 | 40 | 2 | 10 | 0.1 | t4 | |||||||
(1)设计实验2和实验3的目的是研究 对化学反应速率的影响;
(2)为研究温度对化学反应速率的影响,可以将实验 和实验 作对比(填序号);
(3)将实验1和实验2作对比,t1 t2(填“>”、“<”或“=”)。
Ⅱ.以KI和FeCl3反应为例(2Fe3++2![]() 2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1mol![]() KI溶液
KI溶液
②0.1mol![]() FeCl3溶液
FeCl3溶液
③0.1mol![]() FeCl2溶液
FeCl2溶液
④0.1mol![]() 盐酸
盐酸
⑤0.1mol![]() KSCN溶液
KSCN溶液
⑥CCl4
实验步骤:(1)取5mL 0.1mol![]() KI溶液,再滴加几滴0.1mol
KI溶液,再滴加几滴0.1mol![]() FeCl3溶液;
FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂 (填序号),现象 ,说明此反应存在一定的限度。
Ⅲ.N2O4可分解为NO2。在100mL密闭容器中投入0.01mol N2O4,利用现代化学实验技术跟踪测量c(NO2)。c(NO2)随时间变化的数据记录如图所示:
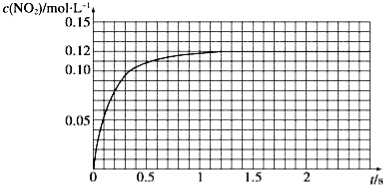
(1)反应容器中最后剩余的物质有 ,其中N2O4的物质的量为 mol;
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后 。(选填“变大”,“变小”或“不变”)