题目内容
【题目】1,4—环己二醇是一种重要的化工原料,它可通过下列路线合成:
![]()
(1)反应③、⑥的反应类型分别是____、____。
(2)有机物C按照系统命名,其名称是:____,D中的官能团名称是____。
(3)写出反应⑧的化学方程式为____。
(4)环己烷的一种同分异构体W,已知W分子中所有碳原子均在同一平面上,写出其结构简式____,W是否具有顺反异构____。(填”是“或”否“)
【答案】(1)消去反应;加成反应;(2)1,2—二氯环己烷;氯原子;碳碳双键;(3)![]() ;(4)
;(4)![]() ;否。
;否。
【解析】
试题分析:反应①应是在催化剂的作用下,发生取代反应,则A结构简式为:![]() ,反应②发生加成反应,反应③发生消去反应,生成
,反应②发生加成反应,反应③发生消去反应,生成![]() ,反应④发生加成反应,C的结构简式
,反应④发生加成反应,C的结构简式![]() ,反应⑤发生消去反应,反应⑥发生加成反应,按照1:1投入,再根据目标产物,发生1,4加成,结构简式
,反应⑤发生消去反应,反应⑥发生加成反应,按照1:1投入,再根据目标产物,发生1,4加成,结构简式![]() ,反应⑦是加成反应,⑦发生取代反应或水解反应,(1)根据上述分析,反应③发生消去反应,反应⑥发生加成反应;(2)根据上述分析,C的名称为1,2-二氯环己烷,D的官能团是氯原子和碳碳双键;(3)反应⑧在NaOH水溶液发生水解反应或取代反应,其反应方程式为:
,反应⑦是加成反应,⑦发生取代反应或水解反应,(1)根据上述分析,反应③发生消去反应,反应⑥发生加成反应;(2)根据上述分析,C的名称为1,2-二氯环己烷,D的官能团是氯原子和碳碳双键;(3)反应⑧在NaOH水溶液发生水解反应或取代反应,其反应方程式为:![]() ;(4)环烷烃和单烯烃互为同分异构体,因此W的结构简式为:
;(4)环烷烃和单烯烃互为同分异构体,因此W的结构简式为:![]() ,没有顺反异构体。
,没有顺反异构体。

 全优点练单元计划系列答案
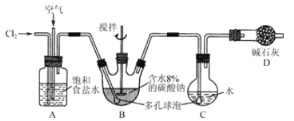
全优点练单元计划系列答案【题目】如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用一玻片盖在培养皿上。下表中对实验现象的描述或所作的解释错误的是( )

选项 | 实验现象 | 解 释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了硫单质 |
C | KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间:
序号 | 反应 温度/℃ | c(H2O2)/ molL﹣1 | V(H2O2) /mL | m(MnO2) /g | t/min | |||||||
1 | 20 | 2 | 10 | 0 | t1 | |||||||
2 | 20 | 2 | 10 | 0.1 | t2 | |||||||
3 | 20 | 4 | 10 | 0.1 | t3 | |||||||
4 | 40 | 2 | 10 | 0.1 | t4 | |||||||
(1)设计实验2和实验3的目的是研究 对化学反应速率的影响;
(2)为研究温度对化学反应速率的影响,可以将实验 和实验 作对比(填序号);
(3)将实验1和实验2作对比,t1 t2(填“>”、“<”或“=”)。
Ⅱ.以KI和FeCl3反应为例(2Fe3++2![]() 2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1mol![]() KI溶液
KI溶液
②0.1mol![]() FeCl3溶液
FeCl3溶液
③0.1mol![]() FeCl2溶液
FeCl2溶液
④0.1mol![]() 盐酸
盐酸
⑤0.1mol![]() KSCN溶液
KSCN溶液
⑥CCl4
实验步骤:(1)取5mL 0.1mol![]() KI溶液,再滴加几滴0.1mol
KI溶液,再滴加几滴0.1mol![]() FeCl3溶液;
FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂 (填序号),现象 ,说明此反应存在一定的限度。
Ⅲ.N2O4可分解为NO2。在100mL密闭容器中投入0.01mol N2O4,利用现代化学实验技术跟踪测量c(NO2)。c(NO2)随时间变化的数据记录如图所示:
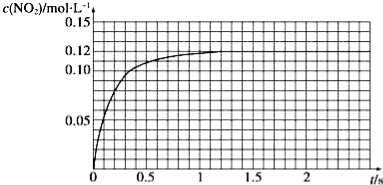
(1)反应容器中最后剩余的物质有 ,其中N2O4的物质的量为 mol;
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后 。(选填“变大”,“变小”或“不变”)
【题目】C、N、O、Al、Si 、Cl、Fe是七种常见元素
(1)N元素位于周期表第 周期,第 族。
(2)用“>”、“<”或“= ”填空:
离子半径 | 得电子能力 | 酸性 | 金属性 |
O2― Al3+ | 16O 18O | H2CO3 HNO3 | Fe Al |
(3)SiO2及硅酸盐在自然界广泛存在,在日常生活、生产、科研及新型材料等方面有着重要的用途。高岭土[Al2(Si2O5)(OH)4]改写成氧化物的形式为 。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目: 。
(5)将铝片(表面除去氧化膜)与碳棒用导线连接后插入稀NaOH溶液中可以构成原电池,电池正极为 ,电池负极反应的电极方程式为 。