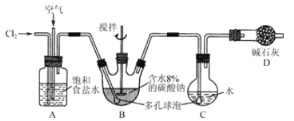
��Ŀ����
����Ŀ��(14��)�±�ΪԪ�����ڱ���һ���֡�
̼ | �� | Y | |
X | �� | Z |
�ش��������⣺
��1��ZԪ�������ڱ��е�λ��Ϊ ��
��2������Ԫ��ԭ�Ӱ뾶������(дԪ�ط���) ��
��3��������ʵ��˵��YԪ�صķǽ����Ա�SԪ�صķǽ�����ǿ���� ��
a��Y������H2S��Һ��Ӧ����Һ�����
b����������ԭ�У�1molY���ʱ�1molS�õ��Ӷ�
c��Y��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
��4��̼��þ�γɵ�1mol������Q��ˮ��Ӧ������2molMg(OH)2��1mol��������������̼��������Ϊ9:1�����ĵ���ʽΪ ��Q��ˮ��Ӧ�Ļ�ѧ����ʽΪ ��
��5��X��Z��Ԫ�صĵ��ʷ�Ӧ����1molX����ۻ�����ָ������£�����687kJ����֪�û�������ۡ��е�ֱ�Ϊ��69����58����д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��6��ͭ��һ��Ũ�ȵ����������Ļ���ᷴӦ�����ɵ���ֻ������ͭ��ͬʱ���ɵ�����������ɱ�������Ԫ����ɣ��������Է���������С��50��Ϊ��ֹ��Ⱦ����������������ȫת��Ϊ��ۺ������Σ�����1L 2.2mol/LNaOH��Һ��1molO2������������ķ���ʽ�����ʵ����ֱ�Ϊ ����������ͭ���ʵ���Ϊ ��
���𰸡���1���������ڣ�VIIA�壻
��2��Si��
��3��ac
��4��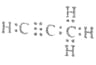 Mg2C3+4H2O=2Mg(OH)2+C3H4����
Mg2C3+4H2O=2Mg(OH)2+C3H4����
��5��Si(s)+2Cl2(g)=SiCl4(l) ��H=��687kJ/mol��
��6��NO 0.9mol��NO21.3mol ��2mol��
���������������������Ԫ�����ڱ��ṹ��֪��XΪSiԪ�أ�YΪOԪ�أ�ZΪClԪ�أ�
��1��ZΪClԪ�أ���ԭ������Ϊ17��λ�����ڱ��е������ڡ�����A�壬�ʴ�Ϊ���������ڵ�����A�壻
��2��ͬһ���ڴ������ң�ԭ�Ӱ뾶��С��ͬһ������ϵ��£�ԭ�Ӱ뾶��������ԭ�Ӱ뾶����ΪSi���ʴ�Ϊ��Si��
��3��a��Y������H2S��Һ��Ӧ����Һ����ǣ�˵�������������Ա���ǿ����˵��YԪ�صķǽ����Ա�SԪ�صķǽ�����ǿ����a��ȷ��b����������ԭ��Ӧ�У�1molY���ʱ�1molS�õ��Ӷ࣬������ǿ�����ʧ������û�б�Ȼ��ϵ����b����c��Ԫ�صķǽ�����Խǿ���⻯����ȶ���Խǿ��Y��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸߣ�˵��Y�ķǽ����Խ�ǿ����c��ȷ���ʴ�Ϊ��ac��
��4������������̼��������Ϊ9��1��C��H�����ʵ���֮��Ϊ=3��4��������̼��þ���ɵ�1mol������Q��ˮ��Ӧ����2mol Mg(OH)2��1mol������֪�����ķ���ʽΪC3H4��Q�Ļ�ѧʽΪMg2C3��Mg2C3��ˮ��Ӧ����������þ��C3H4������ʽΪ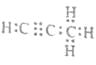 ����Ӧ�Ļ�ѧ����ʽΪMg2C3+4H2O=2Mg(OH)2+C3H4�����ʴ�Ϊ��
����Ӧ�Ļ�ѧ����ʽΪMg2C3+4H2O=2Mg(OH)2+C3H4�����ʴ�Ϊ��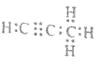 ��Mg2C3+4H2O=2Mg(OH)2+C3H4����
��Mg2C3+4H2O=2Mg(OH)2+C3H4����
��5��X(Si)��Z(Cl)��Ԫ�صĵ��ʷ�Ӧ����1molX����ۻ�����SiCl4������687KJ����֪�û�������ۡ��е�ֱ�Ϊ-69����58����������SiCl4ΪҺ̬���÷�Ӧ���Ȼ�ѧ����ʽΪ��Si(s)+2Cl2(g)=SiCl4(l)��H=-687kJ/mol���ʴ�Ϊ��Si(s)+2Cl2(g)=SiCl4(l)��H=-687kJ/mol��
��6��ͭ��һ��Ũ�ȵ����������Ļ���ᷴӦ�����ɵ���ֻ������ͭ��ͬʱ���������ж�����ΪNO��NO2������ת��ΪNaNO3��1mol�������뷴Ӧת�Ƶ��ӵ����ʵ���Ϊ4mol�����NO��NO2�����ʵ����ֱ�Ϊxmol��ymol����x+y��2.2��x+3y��4����ã�x=1.3��y=0.9�����ݵ����غ㣺n(CuSO4)=![]() =2mol���ʴ�Ϊ��NO 0.9mol��NO21.3mol��2mol
=2mol���ʴ�Ϊ��NO 0.9mol��NO21.3mol��2mol

 ��ĩ100�ִ��غ�������ϵ�д�
��ĩ100�ִ��غ�������ϵ�д�����Ŀ��Ϊ��̽����ѧ��Ӧ���ʺͻ�ѧ��Ӧ�ȵ��й����⣬ij�о�С�����������ʵ�飺
����H2O2�ķֽⷴӦΪ�о�����ʵ�鷽�������ݼ�¼�����t��ʾ�ռ�a mL O2�����ʱ����
��� | ��Ӧ �¶�/�� | c��H2O2��/ molL��1 | V��H2O2�� /mL | m��MnO2�� /g | t/min | |||||||
1 | 20 | 2 | 10 | 0 | t1 | |||||||
2 | 20 | 2 | 10 | 0.1 | t2 | |||||||
3 | 20 | 4 | 10 | 0.1 | t3 | |||||||
4 | 40 | 2 | 10 | 0.1 | t4 | |||||||
��1�����ʵ��2��ʵ��3��Ŀ�����о� �Ի�ѧ��Ӧ���ʵ�Ӱ����
��2��Ϊ�о��¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬���Խ�ʵ�� ��ʵ�� ���Աȣ����������
��3����ʵ��1��ʵ��2���Աȣ�t1 t2�����������������=������
����KI��FeCl3��ӦΪ����2Fe3++2![]() 2Fe2++I2�����ʵ�飬̽���˷�Ӧ����һ�����ȣ���ѡ�Լ���
2Fe2++I2�����ʵ�飬̽���˷�Ӧ����һ�����ȣ���ѡ�Լ���
��0.1mol![]() KI��Һ
KI��Һ
��0.1mol![]() FeCl3��Һ
FeCl3��Һ
��0.1mol![]() FeCl2��Һ
FeCl2��Һ
��0.1mol![]() ����
����
��0.1mol![]() KSCN��Һ
KSCN��Һ
��CCl4
ʵ�鲽�裺��1��ȡ5mL 0.1mol![]() KI��Һ���ٵμӼ���0.1mol
KI��Һ���ٵμӼ���0.1mol![]() FeCl3��Һ��
FeCl3��Һ��
��2����ַ�Ӧ����Һ�ֳ����ݣ�
��3��ȡ����һ�ݣ����Լ��ޣ���CCl4������ɫ��˵����Ӧ���ɵ⣻
��4����ȡһ�ݣ����Լ� ��������������� ��˵���˷�Ӧ����һ��������
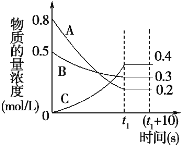
��N2O4�ɷֽ�ΪNO2����100mL�ܱ�������Ͷ��0.01mol N2O4�������ִ���ѧʵ�鼼�����ٲ���c��NO2����c��NO2����ʱ��仯�����ݼ�¼��ͼ��ʾ��
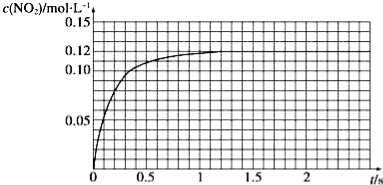
��1����Ӧ���������ʣ��������� ������N2O4�����ʵ���Ϊ mol��
��2��c��NO2����ʱ��仯�����߱�����ʵ���õĻ�ѧ��Ӧ��������С����� ����ѡ���������������С��������������