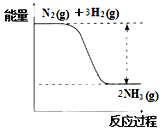
��Ŀ����
����Ŀ��ǰ������ԭ�������������������Ԫ��A��B��C��D��E��F�У�A��B����ͬһ��������������Ԫ�أ�B��̬ԭ��2p���������������������ȫ��ͬ�ĵ��ӣ�C��̬ԭ�Ӻ������ռ��9���������ֻ��1��δ�ɶԵ��ӣ�D��E��F��λ��ͬһ���ڵĽ���Ԫ�أ� D��E��̬ԭ�ӵļ۵��Ӳ���δ�ɶԵ������ֱ�Ϊ4��2����ԭ���������2��F��ds��Ԫ�أ�F��̬ԭ�ӵļ۵��Ӳ���ֻ��1��δ�ɶԵ�����
�ش��������⣺
��1��EԪ�������ڱ��е�λ����____________��E�ļ۲�����Ų�ͼΪ________________��E�����ܵ����ԭ����_______________��
��2��A��B��D����Ԫ���γ������D3[D(AB)6]2���������������������___��1 ��AB�������к���_____�� ������
��3��AԪ����������������Aԭ�ӵ��ӻ����������______��BC3���ӵ����幹����_____________��
��4�����Ƶ�F(OH)2�ܹ��ܽ���ŨNaOH��Һ���γ�һ�������ӣ���Ӧ�����ӷ���ʽ��__��
��5��E��FԪ�صĵڶ������ֱܷ��ǣ�IE=1753kJ/mol��IF=1958kJ/mol�� IF��IE��ԭ����___��
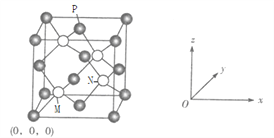
��6��C��FԪ���γɵ�һ�ֻ����ᄃ������ͼ��Fλ�����ĺͶ��㣬�侧������Ϊa pm��
����֪M�������Ϊ![]() ����N�������Ϊ______��P�������Ϊ_______��
����N�������Ϊ______��P�������Ϊ_______��
�������ӵ�������NA��ʾ����þ������ܶ���_____________g/cm3��ֻҪ������ʽ����
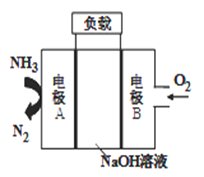
���𰸡� ��4���ڢ��� 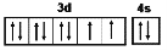 �������ǽ������壬�ɽ��������Ӻ����ɵ��ӹ��ɣ����ɵ�������ӵ糡�������¿ɷ��������ƶ� Fe3+ 2 sp ������ Cu(OH)2 + 2OH��
�������ǽ������壬�ɽ��������Ӻ����ɵ��ӹ��ɣ����ɵ�������ӵ糡�������¿ɷ��������ƶ� Fe3+ 2 sp ������ Cu(OH)2 + 2OH��![]() [Cu(OH)4]2- ͭʧȥ����ȫ������3d10���ӣ���ʧȥ����4s1���ӡ�
[Cu(OH)4]2- ͭʧȥ����ȫ������3d10���ӣ���ʧȥ����4s1���ӡ� ![]()
![]()
![]()
�����������������B��̬ԭ��2p���������������������ȫ��ͬ�ĵ��ӣ�B�ĺ�������Ų�Ϊ1s22s22p3,B��NԪ�أ�A��B����ͬһ�����������ڵ�Ԫ��,ԭ��������������A��CԪ�أ�C��̬ԭ�Ӻ������ռ��9���������ֻ��1��δ�ɶԵ��ӣ�C�ĺ�������Ų�Ϊ1s22s22p63s23p5,C��ClԪ�أ�D��E��F��λ��ͬһ���ڵĽ���Ԫ�أ�D��E��̬ԭ�ӵļ۵��Ӳ���δ�ɶԵ������ֱ�Ϊ4��2����ԭ���������2��D�ĺ�������Ų�Ϊ1s22s22p63s23p63d64s2,D�� Fe��E��NiԪ�أ�F��ds��Ԫ�أ�F��̬ԭ�ӵļ۵��Ӳ���ֻ��1��δ�ɶԵ��ӣ�F�ĺ�������Ų�Ϊ1s22s22p63s23p63d104s1,F��Cu��
��������1��NiԪ�������ڱ��е�λ���ǵ�4���ڢ��壬NiԪ�صļ۲����Ϊ3d��4s����ϵĵ��ӣ��۵��ӹ��ʽΪ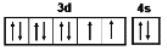 ���������ǽ������壬�ɽ��������Ӻ����ɵ��ӹ��ɣ����ɵ�������ӵ糡�������¿ɷ��������ƶ����������ܵ��硣
���������ǽ������壬�ɽ��������Ӻ����ɵ��ӹ��ɣ����ɵ�������ӵ糡�������¿ɷ��������ƶ����������ܵ��硣
��2��A��B��D����Ԫ���γ������Fe3[Fe(CN)6]2��[Fe(CN)6]3-������������Fe3+��C��N֮��Ϊ����������1 ��CN�������к���2�� �м���
��3��CO2��C�ļ۵��Ӷ�Ϊ![]() ��ԭ�ӵ��ӻ����������sp�ӻ���NCl3������Nԭ�Ӽ۵��Ӷ�Ϊ
��ԭ�ӵ��ӻ����������sp�ӻ���NCl3������Nԭ�Ӽ۵��Ӷ�Ϊ![]() ����һ�Թ¶Ե��ӣ��������幹���������Ρ�
����һ�Թ¶Ե��ӣ��������幹���������Ρ�
��4��Cu(OH)2��ŨNaOH��Һ���γ�һ�������ӣ���Ӧ�����ӷ���ʽ��Cu(OH)2 + 2OH��![]() [Cu(OH)4]2-��
[Cu(OH)4]2-��
��5���ڶ���������ʧȥ�ĵڶ������ӣ�ͭʧȥ����ȫ������3d10���ӣ���ʧȥ����4s1���ӣ����� IF��IE��
��6��C��FԪ���γɵ�һ�ֻ����ᄃ������ͼ��Fλ�����ĺͶ��㣬�侧������Ϊa pm��
����֪M�������Ϊ![]() ����N�������Ϊ
����N�������Ϊ![]() ��P�������Ϊ
��P�������Ϊ![]() ��
��
���ݾ�̯ԭ��������ͭԭ����Ϊ![]() ��Clԭ����Ϊ4,1mol����������Ϊ99.5
��Clԭ����Ϊ4,1mol����������Ϊ99.5![]() g��1mol���������Ϊ
g��1mol���������Ϊ![]() ����þ�����ܶ���
����þ�����ܶ���![]() g/cm3��
g/cm3��

����Ŀ��t��ʱ����0.200mol/L��ijһԪ��HA��0.200mol/L��NaOH��Һ�������ϣ����û����Һ�в�������Ũ�����±���
�� | H+ | Na+ | A- |
Ũ�ȣ�mol/L�� | 2.50��10-10 | 0.100 | 9.92��10-2 |
����˵������ȷ����
A. ������Һ�У� c(Na+) ��c(A-) ��c(HA) ��c(OH-)
B. t��ʱ��ˮ�����ӻ�Kw < 1.0��10-14
C. t��ʱ��һԪ��HA�ĵ��볣��K=3.10��10-8
D. t��ʱ��0.100mol/LNaA��Һ��A-��ˮ����Ϊ0.400%