题目内容
【题目】氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
合成氨的反应中的能量变化如图所示。
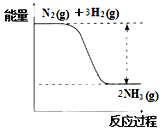
①该反应是___________反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量_____(填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是___________(填序号)。
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3 mol H-H键的同时断裂6 mol N-H键
C.N2 、H2 、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
③一种用于驱动潜艇的液氨-液氧燃料电池原理示意如图:
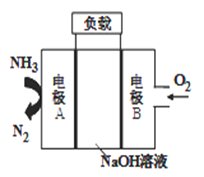
电极A上发生的电极反应为:_____________________。
若电池工作一段时间后,消耗标准状况下的氧气11.2L,则该过程转移电子______mol.
【答案】 放热 小于 AC 2NH3-6e+— 6OH—=N2 + 6H2O 2
【解析】①反应物的总能量高于生成物总能量,该反应是放热反应,其原因是反应物化学键断裂吸收的总能量小于生成物化学键形成放出的总能量。②A.根据质量守恒定律判断容器内气体的质量保持不变,容器的容积恒定,容器内混合气体的密度为恒量,容器中混合气体的密度不随时间变化不能说明反应达到平衡状态,A正确;B.断裂3 mol H-H键的同时断裂6 mol N-H键,二者分别为正反应速率和逆反应速率,能说明反应达到平衡状态,B错误;C.N2、H2、NH3的物质的量之比为1:3:2,反应不一定达到平衡状态,C正确;D.该反应正向为气体物质的量减小的反应,混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以容器中混合气体的平均相对分子质量不随时间变化说明反应达到平衡状态,D错误,答案选AC。③A电极氨气失去电子转化为氮气,电极反应式为 2NH3-6e-+ 6OH-=N2 + 6H2O;11.2L氧气是0.5mol,根据O2+ 2H2O+ 4e-=4OH-可知转移电子0.5mol×4=2mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列鉴别浓硫酸和稀硫酸的操作与结论有误的是( )
操作 | 结论 | |
A | 分别加入金属铝片 | 产生刺激性气味者为浓硫酸 |
B | 分别加入到盛水的试管中 | 剧烈放热者为浓硫酸 |
C | 取等体积样品,称量质量 | 质量大者为浓硫酸 |
D | 分别滴在火柴梗上 | 变黑者为浓硫酸 |
A. A B. B C. C D. D