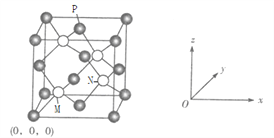
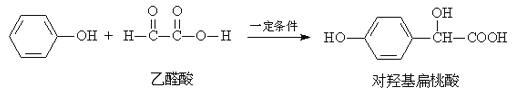
题目内容
【题目】已知:pAg=-lg(Ag+),Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol![]() L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl) >Ksp(AgI)]
L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl) >Ksp(AgI)]
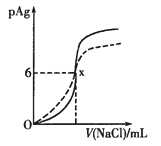
A.相同温度下,AgCl在纯水和在NaCl溶液中的溶解度相等
B.原AgNO3溶液的物质的量浓度为0.1mol![]() L-1
L-1
C.图中x点的坐标为(100,6)
D.把0.1mol![]() L-1的NaCl溶液换成0.1mol
L-1的NaCl溶液换成0.1mol![]() L-1的NaI溶液则图像变为虚线部分
L-1的NaI溶液则图像变为虚线部分
【答案】C
【解析】
试题分析:A.AgCl在水中存在如何平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),相同温度下,浓度增大平衡逆向移动,溶解度减小。所以,AgCl在纯水比在NaCl溶液中的溶解度大,故A错误;B.图中原点pAg=0,则Ag+的浓度为:c(Ag+)=100 mol
Ag+(aq)+Cl-(aq),相同温度下,浓度增大平衡逆向移动,溶解度减小。所以,AgCl在纯水比在NaCl溶液中的溶解度大,故A错误;B.图中原点pAg=0,则Ag+的浓度为:c(Ag+)=100 mol![]() L-1,即原AgNO3溶液的物质的量浓度为1 mol
L-1,即原AgNO3溶液的物质的量浓度为1 mol![]() L-1,故B错误;C.x点c(Ag+)=10-6 mol
L-1,故B错误;C.x点c(Ag+)=10-6 mol![]() L-1,一般认为溶液中离子浓度小于10-6 mol
L-1,一般认为溶液中离子浓度小于10-6 mol![]() L-1,即沉淀完全,则AgNO3与NaCl恰好反应,n(NaCl)=n(AgNO3)=0.01L×1mol
L-1,即沉淀完全,则AgNO3与NaCl恰好反应,n(NaCl)=n(AgNO3)=0.01L×1mol![]() L-1=0.01mol,所以V(NaCl)=100mL,即x点的坐标为(100,6),故C正确;D.与AgCl相比,碘化银的Ksp(AgI)更小,所以把0.1 mol
L-1=0.01mol,所以V(NaCl)=100mL,即x点的坐标为(100,6),故C正确;D.与AgCl相比,碘化银的Ksp(AgI)更小,所以把0.1 mol![]() L-1的NaCl换成0.1mol
L-1的NaCl换成0.1mol![]() L-1NaI,则溶液中c(Ag+)更小,则pAg更大,图象不符,故D错误。
L-1NaI,则溶液中c(Ag+)更小,则pAg更大,图象不符,故D错误。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】下列鉴别浓硫酸和稀硫酸的操作与结论有误的是( )
操作 | 结论 | |
A | 分别加入金属铝片 | 产生刺激性气味者为浓硫酸 |
B | 分别加入到盛水的试管中 | 剧烈放热者为浓硫酸 |
C | 取等体积样品,称量质量 | 质量大者为浓硫酸 |
D | 分别滴在火柴梗上 | 变黑者为浓硫酸 |
A. A B. B C. C D. D