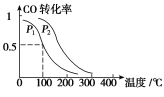
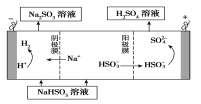
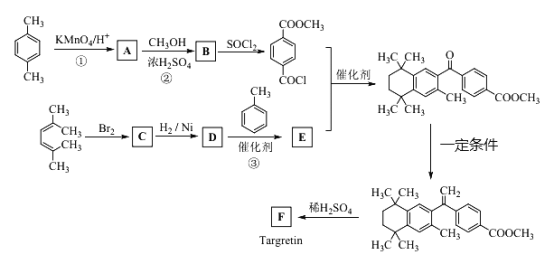
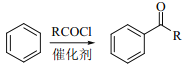
题目内容
【题目】t℃时,将0.200mol/L的某一元酸HA与0.200mol/L的NaOH溶液等体积混合,所得混合溶液中部分离子浓度如下表。
微粒 | H+ | Na+ | A- |
浓度(mol/L) | 2.50×10-10 | 0.100 | 9.92×10-2 |
下列说法中正确的是
A. 所得溶液中: c(Na+) >c(A-) >c(HA) >c(OH-)
B. t℃时,水的离子积Kw < 1.0×10-14
C. t℃时,一元酸HA的电离常数K=3.10×10-8
D. t℃时,0.100mol/LNaA溶液中A-的水解率为0.400%
【答案】C
【解析】根据电荷守恒,c(Na+)+c(H+)=c(A-)+c(OH-),c(OH-)=8×10-4;将0.200mol/L的某一元酸HA与0.200mol/L的NaOH溶液等体积混合,恰好反应,溶质是0.100mol/L的某一元酸NaA,所得溶液中: c(Na+) >c(A-)>c(OH-)>c(HA),故A错误;t℃时,水的离子积Kw =8×10-4×2.50×10-10=2×10-14> 1.0×10-14,故B错误;根据物料守恒c(A-)+c(HA)=0.1,c(HA)= 8×10-4,t℃时,一元酸HA的电离常数K=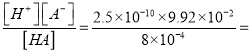 3.10×10-8,故C错误;t℃时,0.100mol/LNaA溶液中A-的水解率为
3.10×10-8,故C错误;t℃时,0.100mol/LNaA溶液中A-的水解率为![]() ,故D错误。
,故D错误。

练习册系列答案
相关题目