题目内容
3.常温下,下列有关溶液的叙述正确的是( )| A. | 将PH=1的醋酸和PH=13的Na OH溶液混合后,若c(CH3COO-)=c(Na+),则溶液显中性 | |
| B. | 在Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-) | |
| C. | pH=6的CH3COOH溶液和pH=6的NH4Cl溶液,由水电离出的c(H+)均为1×10-8mol•L-1 | |
| D. | 在饱和Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
分析 A、电荷守恒分析解答;
B、根据电荷守恒分析解答;
C、pH=6的CH3COOH中由水电离出的c(H+)水=c(OH-)水=$\frac{1{0}^{-14}}{1{0}^{-6}}$=10-8 mol/L,pH=6的NH4Cl溶液中由水电离出的c(H+)=10-6 mol/L;
D、根据物料守恒分析解答.
解答 解:A、电荷守恒,可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),又因为:c(CH3COO-)=c(Na+),所以c(OH-)=c(H+),溶液呈中性,故A正确;
B、在Na2SO3溶液中,根据电荷守恒可知:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故B错误;
C、pH=6的CH3COOH中由水电离出的c(H+)水=c(OH-)水=$\frac{1{0}^{-14}}{1{0}^{-6}}$=10-8 mol/L,pH=6的NH4Cl溶液中由水电离出的c(H+)=10-6 mol/L,故C错误;
D、在饱和Na2CO3溶液中,根据物料守恒:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法,比较容易.

练习册系列答案
相关题目
18.下列实验操作或事实与预期实验目的或所得结论对应正确的是( )
| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 | 说明原溶液中一定含有FeCl3 |
| B | 白色Mg(OH)2 $\stackrel{CuSO_{4}溶液}{→}$蓝色Cu(OH)2 | Mg(OH)2的溶度积大于Cu(OH)2 |
| C | 新收集的酸雨$\stackrel{Ba(NO_{3})_{2}溶液}{→}$白色沉淀 | 酸雨中一定含有SO42- |
| D | H3PO3+2HaOH(足量)═Na2HPO2+2H2O | H3PO3属于三元酸 |
| A. | A | B. | B | C. | C | D. | D |
15.实验室对茶叶中铁元素的检验,可经以下四个步骤完成:①将茶叶灼烧灰化;②茶叶灰用浓硝酸浸取并加蒸馏水稀释;③过滤得到滤液;④用KSCN溶液进行检验.下列说法中正确的是( )
| A. | 步骤①所用仪器包括蒸发皿、酒精灯、玻璃棒等 | |
| B. | 步骤②所用的浓硝酸应保存在带橡皮塞的棕色试剂瓶中 | |
| C. | 步骤③可以不做,改为将悬浊液静置一段时间 | |
| D. | 步骤④观察到溶液变红色,证明茶叶中含有Fe3+ |
13.根据下列各图曲线表征的信息,得出的结论不正确的是( )
| A. | 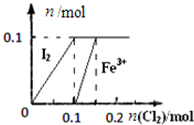 表示向100mL1 mol•L-1 FeI2溶液中逐渐通入Cl2,I2和Fe3+物质的量变化关系 | |
| B. | 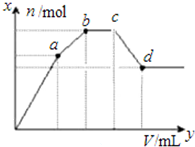 表示向100mL 0.1 mol•L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol•L-1 Ba(OH)2溶液,沉淀物质的量变化的关系 | |
| C. |  表示在不同温度下,水溶液中c(H+)与c(OH-)变化关系 | |
| D. |  得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 |


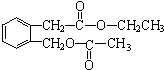 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$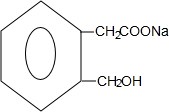 +CH3COONa+CH3CH2OH+H2O;反应类型是水解反应(或取代反应);
+CH3COONa+CH3CH2OH+H2O;反应类型是水解反应(或取代反应);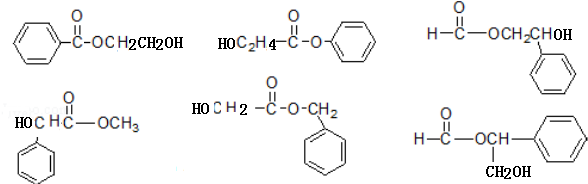 (任写两个).
(任写两个).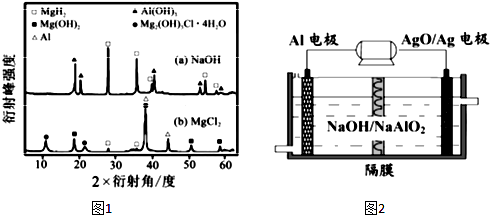
 As、N、0等非金属元素的化合物在工业生产中有重要的应用.
As、N、0等非金属元素的化合物在工业生产中有重要的应用.