题目内容
1.如图是某有机物核磁共振氢谱图,但该物质可能是( )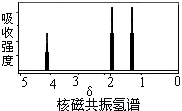
| A. | CH3COOCH2CH3 | B. | CH3CH=CHCH3 | C. | CH3CH2CH3 | D. | CH3CHOHCH3 |
分析 根据核磁共振氢谱有几种吸收峰,故有机物分子中有几种H原子,峰的面积之比等于氢原子的个数之比,结合等效氢判断.
解答 解:核磁共振氢谱中给出3种峰,说明该分子中有3种H原子,
A.CH3COOCH2CH3中有3种氢原子,核磁共振氢谱中有3种峰,面积之比为3:3:2,故A正确;
B、CH3CH=CHCH3中有2种氢原子,核磁共振氢谱中有2种峰,面积之比为3:1,故B错误;
C、CH3CH2CH3中有2种氢原子,核磁共振氢谱中有2种峰,面积之比为3:1,故C错误;
D、CH3CHOHCH3中有4种氢原子,核磁共振氢谱中有4种峰,面积之比为3:3:1:1,故D错误,
故选A.
点评 本题考查核磁共振氢谱,难度不大,清楚核磁共振氢谱中峰值数等于有机物中氢原子的种类数是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.电解精炼粗铜时,下列叙述不正确的是( )
| A. | 与电源正极相连的电极是粗铜板 | B. | 阴极发生反应:Cu2++2e-═Cu | ||
| C. | 电解池的阳极材料为粗铜 | D. | 粗铜板上发生还原反应 |
12.下列说法正确的是( )
| A. | 浓硫酸能使蔗糖变黑,体现浓硫酸具有强酸化性 | |
| B. | 铵盐受热易分解,均有NH3产生 | |
| C. | 闪电时,N2转化为NO可以称为氮的固定 | |
| D. | 化工厂可通过加高烟囱排放废气,防止形成酸雨 |
9.在一密闭容器中进行反应:2SO2(g)+O2(g)≒2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol•L-1、0.1mol•L-1、0.2mol•L-1,当反应达到平衡时,可能存在的数据是( )
| A. | SO2为0.4 mol•L-1、O2为0.2 mol•L-1 | |
| B. | SO2为0.25 mol•L-1 | |
| C. | SO2、SO3均为0.15 mol•L-1 | |
| D. | SO3为0.4 mol•L-1 |
16.下列关于元素周期表的说法正确的是( )
| A. | ⅠA族元素也称为碱金属元素 | |
| B. | 稀有气体元素原子的最外层电子数均为8 | |
| C. | 过渡元素全部是金属元素,因此它们又被称为过渡金属 | |
| D. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 |
6.要提纯下列物质(括号内物质为杂质),实验操作合理的是( )
| A. | 硫酸铁溶液(硫酸亚铁):通入足量氯气,充分反应后加热,使多余氯气逸出 | |
| B. | 苯(苯酚):加入足量的浓溴水,充分振荡,静置分层后分离 | |
| C. | CO2(SO2):通入盛有Na2CO3溶液的洗气瓶 | |
| D. | Mg(OH)2:放入水中调成浆状,加入足量MgCl2溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤 |
13.NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 标况下,2.24L Cl2完全溶于水转移电子数为0.1NA | |
| B. | 1L 0.1mol•L-1 NaClO溶液中,ClO-的数目为NA | |
| C. | 2gNO2和44gN2O4的混合气体所含原子数为3NA | |
| D. | 18gD2O所含的电子数为10NA |
15.下列变化中属于原电池反应的是( )
| A. | 铁锈可用稀盐酸洗去 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 在Fe与稀H2SO4反应时,加几滴CuSO4溶液,可加快反应速率 | |
| D. | 红热的铁丝与水接触表面形成蓝黑色保护层 |