题目内容
20.N是重要的非金属元素,尿素、羟胺、硝酸、亚硝酸钠均为重要的含氮化合物.(1)尿素[CO(NH2)2]是人类利用无机物合成的第一种有机物.
①尿素中元素原子半径最大的原子结构示意图为
 ;
;②尿素在土壤中的脲酶作用下会水解生成碳酸铵或碳酸氢铵,若与碱性肥料混合施用,会造成氮元素损失,请用离子方程式解释其原因NH4++OH-=NH3.H2O=NH3↑+H2O;
③已知:20°C时,H2CO3:Ka1=4.2×10ˉ7、Ka2=5.6×10ˉ11;NH3•H2O:Kb=1.7×10ˉ5,碳酸氢铵溶液中HCO3-、NH4+、OHˉ、H+四种离子浓度由大到小的顺序为c(NH4+)>c(HCO3-)>c(OH-)>c(H+)
(2)羟胺(NH2OH)可看做是氨分子内的1个氢原子被羟基取代的物质,常用作还原剂.
①利用羟胺的还原性,可以除去含Fe2+中的Fe3+,氧化产物是一种性质稳定、无污染的气体,写出反应的离子方程式2NH2OH+2Fe3+=2Fe2++N2↑+2H2O+2H+
②制备NH2OH•HCl(盐酸羟胺)的一种工艺流程如图所示:
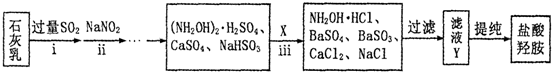
ⅰ步骤中,发生反应的化学方程式为Ca(OH)2+2SO2=Ca(HSO3)2;
ⅱ步骤中使用的NaNO2外观酷似食盐,误食会中毒.可用电解法将工业废水中少量的NO2ˉ转化为N2以降低其危害.写出NO2-在酸性条件下转化为氮气的电极反应式为2NO2-+8H++6e-=N2+4H2O.
ⅲ步骤中,X为BaCl2(填化学式);若要使滤液Y中SO42ˉ、SO32ˉ浓度均小于1×10ˉ5mol/L,溶液中Ba2+浓度应不小于5.0×10-5mol/L.[已知KSP(BaSO3)=5.0×10ˉ10;KSP(BaSO4)=1.1×10ˉ10]
③用惰性电极电解硝酸溶液可制备NH2OH.写出其阳极反应式4OH--4e-=O2↑+2H2O或2H2O-4e-=O2↑+4H+.
分析 (1)①尿素[CO(NH2)2]中C原子半径最大;
②碱性条件下,铵根离子和氢氧根离子反应生成一水合氨,一水合氨不稳定易分解生成氨气和水;
③电离平衡常数越大,其电离程度越大,则其离子水解程度越小;
(2)①羟胺被氧化生成氮气;
②i二氧化硫和氢氧化钙反应生成盐和水;
ii电解时,得电子的微粒在阴极上发生还原反应,电解亚硝酸根离子溶液时,阴极上亚硝酸根离子得电子发生还原反应生成氮气和水;
ⅲ由转化前后的物质可知,生成物中引入钡离子和氯离子;Y中SO42ˉ、SO32ˉ浓度均小于1×10ˉ5mol/L,以KSP(BaSO3)计算;
③用惰性电极电解硝酸溶液可制备NH2OH,阳极上氢氧根离子失去电子,阴极上N得到电子.
解答 解:(1)①原子的电子层数越多,其原子半径越大,相同周期的元素中,原子半径随着原子序数的增大而减小,所以原子半径最大的元素是C元素,其原子结构示意图为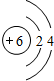 ,故答案为:
,故答案为: ;
;
②碱性条件下,铵根离子和氢氧根离子反应生成一水合氨,一水合氨不稳定易分解生成氨气和水,所以其离子方程式为:NH4++OH-=NH3.H2O=NH3↑+H2O,
故答案为:NH4++OH-=NH3.H2O=NH3↑+H2O;
③电离平衡常数越大,其电离程度越大,则其离子水解程度越小,根据电离平衡常数知,电离程度大小关系是NH3•H2O>H2CO3>HCO3-,则水解程度CO32->HCO3->NH4+,所以碳酸氢铵溶液呈碱性,溶液中还存在碳酸根离子等,所以HCO-3、NH+4、OH-、H+四种离子浓度由大到小c(NH4+)>c(HCO3-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(HCO3-)>c(OH-)>c(H+);
(2)①羟胺被氧化生成氮气和水,反应的离子方程式为2NH2OH+2Fe3+=2Fe2++N2↑+2H2O+2H+,故答案为:2NH2OH+2Fe3+=2Fe2++N2↑+2H2O+2H+;
②i二氧化硫和氢氧化钙反应生成盐和水,反应化学方程式:Ca(OH)2+2SO2=Ca(HSO3)2,故答案为:Ca(OH)2+2SO2=Ca(HSO3)2;
ⅱ电解时,得电子的微粒在阴极上发生还原反应,电解亚硝酸根离子溶液时,阴极上亚硝酸根离子得电子发生还原反应生成氮气和水,电极反应式为2NO2-+8H++6e-=N2↑+4H2O,故答案为:2NO2-+8H++6e-=N2+4H2O;
ⅲ由转化前后的物质可知,生成物中引入钡离子和氯离子,则X为BaCl2;Y中SO42ˉ、SO32ˉ浓度均小于1×10ˉ5mol/L,溶液中Ba2+浓度应不小于$\frac{5.0×1{0}^{-10}}{1×1{0}^{-5}}$=5.0×10-5mol/L,故答案为:BaCl2;5.0×10-5mol/L;
③用惰性电极电解硝酸溶液可制备NH2OH,阳极上氢氧根离子失去电子,阳极反应式为4OH--4e-=O2↑+2H2O或2H2O-4e-=O2↑+4H+,
故答案为:4OH--4e-=O2↑+2H2O或2H2O-4e-=O2↑+4H+.
点评 本题考查较综合,涉及离子浓度大小比较、溶度积的计算、电解、氧化还原反应等,注重高频考点的考查,综合性较强,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 乙醇的结构简式C2H6O | B. | 溴乙烷的分子式C2H5Br | ||
| C. | 羟基的电子式:${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H | D. | 化学名词:苯、油酯、坩锅 |
| A. | 与电源正极相连的电极是粗铜板 | B. | 阴极发生反应:Cu2++2e-═Cu | ||
| C. | 电解池的阳极材料为粗铜 | D. | 粗铜板上发生还原反应 |
| A. | 吸水性 | B. | 腐蚀性 | C. | 强氧化性 | D. | 易挥发性 |
| A. | 标准状况下,1L庚烷所含有的分子数为$\frac{{N}_{A}}{2.4}$ | |
| B. | 1mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数约为16NA | |
| D. | 28g C3H6和C4H8的混合气体中所含C原子数为2NA |
| A. | 浓硫酸能使蔗糖变黑,体现浓硫酸具有强酸化性 | |
| B. | 铵盐受热易分解,均有NH3产生 | |
| C. | 闪电时,N2转化为NO可以称为氮的固定 | |
| D. | 化工厂可通过加高烟囱排放废气,防止形成酸雨 |
| A. | SO2为0.4 mol•L-1、O2为0.2 mol•L-1 | |
| B. | SO2为0.25 mol•L-1 | |
| C. | SO2、SO3均为0.15 mol•L-1 | |
| D. | SO3为0.4 mol•L-1 |
 (1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)
(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)