题目内容
4.现有如下两个反应:(A)KOH+HNO3═KNO3+H2O
(B)H2SO4+Zn═ZnSO4+H2↑
(1)根据两反应本质判断能否设计成原电池:(A)不能(B)能
(2)如果不能,说明其原因(A)的反应是非氧化还原反应,没有电子转移
(3)如果可以,则写出作原电池的正极材料名称:石墨或铜片,电极反应式:负极Zn-2e-=Zn2+;正极2H++2e-=H2↑.
(4)在铜锌原电池中,以稀硫酸为电解质溶液,若工作一段时间后,锌片的质量减少了32.5克,则铜片表面析出了氢气11.2L,(标准状况下),导线中通过1 mol电子.
分析 (1)(2)原电池反应是自发进行的放热的氧化还原反应;
(3)原电池反应式中,失电子化合价升高的金属单质作负极、不如负极活泼的金属或导电的非金属作正极,得电子化合价降低的电解质其原电池电解质;
负极上失电子发生氧化反应、正极上得电子发生还原反应;
(4)根据转移电子相等计算生成氢气体积;根据锌和转移电子之间的关系式计算转移电子物质的量.
解答 解:(1)(A)中各元素化合价不变,不属于氧化还原反应,属于复分解反应,所以不能设计成原电池;
(B)中Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,且该反应是放热反应、能自发进行,所以能设计成原电池,
故答案为:不能;能;
(2)(A)的反应是非氧化还原反应,没有电子转移,所以不能设计成原电池,故答案为:(A)的反应是非氧化还原反应,没有电子转移;
(3)根据电池反应式知,Zn作负极,不如锌活泼的金属或导电的非金属作正极,如碳棒或铜片,负极上锌锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,所以反应式分别为负极:Zn-2e-=Zn2+、正极:2H++2e-=H2↑,
故答案为:石墨或铜片;负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑;
(4)锌失电子的物质的量=$\frac{32.5g}{65g/mol}×2$=1mol,根据转移电子相等得氢气体积=$\frac{1mol}{2}×22.4L/mol$=11.2L;
根据Zn-2e-=Zn2+ 得转移电子的物质的量=$\frac{32.5g}{65g/mol}×2$=1mol,
故答案为:11.2;1.
点评 本题考查原电池设计,侧重考查学生知识运用能力,难点是根据电池反应式确定正负极材料及电解质溶液,根据元素化合价变化确定正负极及电解质溶液,题目难度不大.

| A. | 铁锈可用稀盐酸洗去 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 在Fe与稀H2SO4反应时,加几滴CuSO4溶液,可加快反应速率 | |
| D. | 红热的铁丝与水接触表面形成蓝黑色保护层 |
| A. | 2mol/L NaCl溶液中含有Na+个数为2NA | |
| B. | 常温常压下,80g NH4NO3中含有氮原子数是NA | |
| C. | 18gNH4+中含有的电子数为10NA | |
| D. | 5.6g铁与稀硝酸反应转移的电子数目一定为0.3NA |
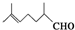 甜瓜醛是调制西瓜、甜瓜、黄瓜、柠檬、苹果等味道的食用香精.其结构简式如图所示.下列有关甜瓜醛的叙述正确的是( )
甜瓜醛是调制西瓜、甜瓜、黄瓜、柠檬、苹果等味道的食用香精.其结构简式如图所示.下列有关甜瓜醛的叙述正确的是( )| A. | 该物质最多可与1 mol氢气发生加成反应 | |
| B. | 该物质的分子式为C9H14O | |
| C. | 加热条件下,该物质能与新制Cu(OH)2悬浊液反应 | |
| D. | 该物质为烯烃 |
| A. | 增加N2的浓度能加快反应速率 | |
| B. | 降低体系温度能加快反应速率 | |
| C. | 使用催化剂不影响反应速率 | |
| D. | 若反应在密闭容器中进行,N2和H2能100%转化为NH3 |
| A. | 34S原子核内中子数为16 | B. | 1H218O的摩尔质量为20g/mol | ||
| C. | 13C和15N原子核内的质子数相差2 | D. | 2H+的核外电子数为2 |
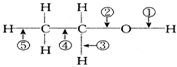
| A. | 和金属钠作用时,键①断裂 | |
| B. | 和浓H2SO4共热至170℃时,键②和⑤断裂 | |
| C. | 在Ag催化剂下和O2反应时,键①和③断裂 | |
| D. | 和CH2COOH共热时,键②断裂 |
| A. | NO2、NO、O2的物质的量浓度之比为2:2:1 | |
| B. | 单位时间内生成n mol O2,同时消耗2n mol NO2 | |
| C. | 混合气体的平均摩尔质量不再改变 | |
| D. | 正反应和逆反应都已停止 |