题目内容
11.下列有关叙述正确的是( )| A. | HClO的电子式为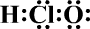 | |
| B. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| C. | CH3COOH溶液和NaCl溶液均通过离子导电,说明CH3COOH和NaCl中均含离子键 | |
| D. | Cl2、SO2均能使品红溶液褪色,说明二者均有较强的氧化性 |
分析 A.次氯酸分子为共价化合物,其中氢原子最外层达到2个电子稳定结构,氯、氧原子达到8电子稳定结构;
B.向沸水中逐滴加入少量饱和FeCl3溶液,氯化铁可水解生成氢氧化铁胶体;
C.CH3COOH为共价化合物,NaCl为离子化合物;
D.SO2与有色有机物发生化合反应,为非氧化还原反应.
解答 解:A.H原子最外层1个电子,Cl原子最外层7个电子,O原子最外层6个电子,次氯酸为共价化合物,其电子式为 ,故A错误;
,故A错误;
B.向沸水中逐滴加入少量饱和FeCl3溶液,氯化铁可水解生成氢氧化铁胶体,为实验室制备氢氧化铁胶体的常用方法,故B正确;
C.CH3COOH为共价化合物,NaCl为离子化合物,所以CH3COOH不含离子键,NaCl中含离子键,故C错误;
D.SO2与有色有机物发生化合反应,为非氧化还原反应,故D错误.
故选B.
点评 题考查较为综合,涉及电解质、胶体的制备、电子式的判断以及漂白原理的分析等问题,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
2.下列反应中的氨与反应4NH3+5O2→4NO+6H2O中的氨作用相同的是( )
| A. | 2Na+2NH3→2NaNH2+H2↑ | B. | NH3+HNO3→NH4NO3 | ||
| C. | 4NH3+6NO→5N2+6H2O | D. | 3SiH4+4NH3→Si3N4+12H2 |
19.生活中的一些问题常涉及到化学知识,则下列叙述正确的是( )
| A. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 | |
| B. | 明矾和漂白粉常用于自来水的处理,两者的作用原理相同 | |
| C. | 氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,与铜发生置换反应 | |
| D. | 晶体硅具有半导体的性质,所以可以制作光导纤维 |
6.铁、铜混合粉末18.0g加入到100ml 5.0mol/LFeCl3溶液中,剩余固体质量为3.2g.下列说法正确的是( )
| A. | 剩余固体是铁、铜混合物 | |
| B. | 反应后溶液中n (Fe2+)+n(Cu2+)=0.75 mol | |
| C. | 反应后溶液中n (Fe3+)=0.10 mol | |
| D. | 原固体混合物中铜的质量是8.0g |
16.下列各组物质的性质比较中,正确的是( )
| A. | 热稳定性:Na2CO3>NaHCO3>H2CO3 | B. | 溶解度:Na2CO3<NaHCO3 | ||
| C. | 熔点:Rb>K>Na>Li | D. | 还原性:Rb<K<Na<Li |
3.下列措施不利于治理雾霾、改善空气质量的是( )
| A. | 推广使用燃煤脱硫技术 | B. | 实施绿化工程 | ||
| C. | 研制开发燃料电池汽车 | D. | 大力发展火电 |
20.取m g相对原子质量为M的某金属与足量稀硫酸反应,在标准状况下产生a L氢气,该反应生成的硫酸盐中金属的化合价为( )
| A. | +$\frac{aM}{11.2m}$ | B. | +$\frac{am}{11.2M}$ | C. | +$\frac{11,2m}{aM}$ | D. | +$\frac{aM}{22.4m}$ |
1.下列物质中最难电离出H+的是( )
| A. | CH3CH2 CH2OH | B. | CH3COOH | C. | H2O | D. | H2CO3 |