题目内容
20.取m g相对原子质量为M的某金属与足量稀硫酸反应,在标准状况下产生a L氢气,该反应生成的硫酸盐中金属的化合价为( )| A. | +$\frac{aM}{11.2m}$ | B. | +$\frac{am}{11.2M}$ | C. | +$\frac{11,2m}{aM}$ | D. | +$\frac{aM}{22.4m}$ |
分析 金属的物质的量为$\frac{m}{M}$mol,生成的氢气的物质的量为$\frac{a}{22.4}$mol,结合电子得失数目相等计算该题.
解答 解:金属的物质的量为$\frac{m}{M}$mol,生成的氢气的物质的量为$\frac{a}{22.4}$mol,则生成氢气转移的电子数为$\frac{a}{11.2}$mol,
设金属的化合物为x,金属与氢气得失电子数目相等,
则$\frac{m}{M}$mol×x=$\frac{a}{11.2}$mol,
x=+$\frac{aM}{11.2m}$.
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析、计算能力的考查,比较基础,注意根据电子转移守恒进行的计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列有关实验的装置、试剂选用或操作正确的是( )
| A.配制0.10mol•L-1溶液 | B.除去CO中的CO2 | C.苯萃取碘水中I2,分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 |  |  | 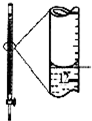 |
| A. | A | B. | B | C. | C | D. | D |
11.下列有关叙述正确的是( )
| A. | HClO的电子式为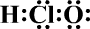 | |
| B. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| C. | CH3COOH溶液和NaCl溶液均通过离子导电,说明CH3COOH和NaCl中均含离子键 | |
| D. | Cl2、SO2均能使品红溶液褪色,说明二者均有较强的氧化性 |
8.可能存在的第119号未知元素,有人称为“类钫”,它位于碱金属族,根据周期表结构及元素性质变化趋势,下列关于碱金属某些元素原子的结构和性质的判断,错误的是( )
①锂与水反应比钠剧烈 ②碱金属单质都需要密封保存在煤油中 ③锂的氧化物暴露在空气中易吸收二氧化碳 ④锂的阳离子的最外层电子数和钠的相同 ⑤“类钫”单质是强还原剂 ⑥“类钫”在化合物中是+1价⑦“类钫”单质的密度大于l g•cm-3⑧“类钫”单质有较高的熔点.
①锂与水反应比钠剧烈 ②碱金属单质都需要密封保存在煤油中 ③锂的氧化物暴露在空气中易吸收二氧化碳 ④锂的阳离子的最外层电子数和钠的相同 ⑤“类钫”单质是强还原剂 ⑥“类钫”在化合物中是+1价⑦“类钫”单质的密度大于l g•cm-3⑧“类钫”单质有较高的熔点.
| A. | ①②④⑧ | B. | ①②③⑦ | C. | ③④⑤⑧ | D. | ①③④⑦ |
15.下列事实与胶体性质无关的是( )
| A. | 向豆浆中加入盐卤做豆腐 | |
| B. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| C. | 高压除尘 | |
| D. | 黄河入海口处容易形成三角洲 |
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为常见的气体,通入澄清石灰水中,石灰水变浑浊.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E元素在地壳中含量位居第四位,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为常见的气体,通入澄清石灰水中,石灰水变浑浊.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E元素在地壳中含量位居第四位,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) .
.