题目内容
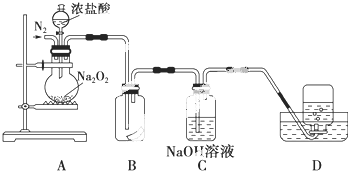
1.我省自贡盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用,没有食盐的生活是不可以想象的.粗盐中含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,请回答粗盐提纯的有关问题:(1)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤加适量盐酸.
其中,在步骤③中涉及的化学反应方程式有BaCl2+Na2CO3=BaCO3↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2NaCl.
(2)将ag粗盐样品溶于水,经过以上一系列提纯操作之后,实验完毕得到bg精盐(不考虑实验过程中操作引起的损耗),下列说法正确的是BD.(NA表示阿伏伽德罗常数)
A.粗盐中Na+数目为$\frac{a{N}_{A}}{58.5}$ B.精盐中NaCl物质的量为$\frac{b}{58.5}$mol C.粗盐中NaCl的质量分数为$\frac{b}{a}$×100% D.粗盐中关于NaCl的量无法确定.
分析 (1)加过量Na2CO3溶液可除去钙离子及上一步中过量的钡离子;
(2)A.粗盐中Na+数目N=nNA=$\frac{m}{M}$NA;
B.精盐中NaCl物质的量为n=$\frac{m}{M}$mol;
C.粗盐中NaCl的质量分数为$\frac{NaCl的质量}{样品质量}$×100%;
D.精盐中NaCl物质的量为n=$\frac{m}{M}$mol.
解答 解:(1)加过量Na2CO3溶液可除去钙离子及上一步中过量的钡离子,涉及化学反应为BaCl2+Na2CO3=BaCO3↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2NaCl,
故答案为:BaCl2+Na2CO3=BaCO3↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2NaCl;
(2)A.粗盐中Na+数目N=nNA=$\frac{m}{M}$NA=$\frac{b}{58.5}$NA,故A错误
B.精盐中NaCl物质的量为n=$\frac{m}{M}$mol=$\frac{b}{58.5}$mol,故B正确;
C.粗盐中NaCl的质量分数为$\frac{NaCl的质量}{样品质量}$×100%,因除杂的氯化钡和氢氧化钠溶液没有给质量,而在此过程中又生成了新的氯化钠,无法计算,故C错误;
D.精盐中NaCl物质的量为n=$\frac{m}{M}$mol,除杂的氯化钡和氢氧化钠溶液没有给质量,而在此过程中又生成了新的氯化钠,无法计算,故D正确;
故答案为:BD.
点评 本题考查混合物分离提纯及物质的量的计算,为高频考点,把握物质的性质及发生的反应、物质的量计算的相关公式为解答的关键,侧重分析与应用能力的考查,注意除杂及粗盐提纯的应用,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
9.某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol•L-1 NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母):a b e.
Ⅱ.某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀.甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数.
(1)按照甲同学的观点,发生反应的离子方程式为Cu2++2HCO3=CuCO3↓+CO2↑+H2O.
(2)两同学利用如图所示装置进行测定:

①在研究沉淀物组成前,须将沉淀从溶液中分离并净化.具体操作依次为过滤、洗涤、干燥.
②装置E中碱石灰的作用是防止空气中CO2和水蒸气进入装置D.
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是cab(填选项序号,下同).若未进行步骤b,将使测量结果偏低.
④若沉淀样品质量为m g,装置D质量增加了n g,则沉淀中CuCO3的质量分数为$\frac{31n}{11m}$.
(3)丙同学认为还可以通过测量CO2的体积或测量样品质量和样品充分灼烧后的质量来测定沉淀中CuCO3的质量分数.
Ⅰ.配制0.50mol•L-1 NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母):a b e.
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)按照甲同学的观点,发生反应的离子方程式为Cu2++2HCO3=CuCO3↓+CO2↑+H2O.
(2)两同学利用如图所示装置进行测定:

①在研究沉淀物组成前,须将沉淀从溶液中分离并净化.具体操作依次为过滤、洗涤、干燥.
②装置E中碱石灰的作用是防止空气中CO2和水蒸气进入装置D.
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是cab(填选项序号,下同).若未进行步骤b,将使测量结果偏低.
④若沉淀样品质量为m g,装置D质量增加了n g,则沉淀中CuCO3的质量分数为$\frac{31n}{11m}$.
(3)丙同学认为还可以通过测量CO2的体积或测量样品质量和样品充分灼烧后的质量来测定沉淀中CuCO3的质量分数.
16.下列有关分液漏斗说法正确的是( )
| A. | 使用分液漏斗前不用检查活塞处是否漏水 | |
| B. | 放气时,直接打开上口玻璃塞 | |
| C. | 分液操作时,下层液体从下端放出,上层液体从上口倒出 | |
| D. | 应选用球形分液漏斗进行分液 |
13.下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
①KHCO3溶液与石灰水反应,②Na2SO3溶液与稀盐酸反应,
③Si与烧碱溶液反应,④Fe与稀硝酸反应,
⑤金属钠在氧气中燃烧,⑥二氧化硫通入石灰水,
⑦铁在硫蒸气中燃烧.
①KHCO3溶液与石灰水反应,②Na2SO3溶液与稀盐酸反应,
③Si与烧碱溶液反应,④Fe与稀硝酸反应,
⑤金属钠在氧气中燃烧,⑥二氧化硫通入石灰水,
⑦铁在硫蒸气中燃烧.
| A. | ①④⑦ | B. | ①②④⑤ | C. | ③⑦ | D. | ③⑤⑦ |
10.下列有关实验的装置、试剂选用或操作正确的是( )
| A.配制0.10mol•L-1溶液 | B.除去CO中的CO2 | C.苯萃取碘水中I2,分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 |  |  | 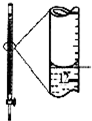 |
| A. | A | B. | B | C. | C | D. | D |
11.下列有关叙述正确的是( )
| A. | HClO的电子式为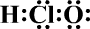 | |
| B. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| C. | CH3COOH溶液和NaCl溶液均通过离子导电,说明CH3COOH和NaCl中均含离子键 | |
| D. | Cl2、SO2均能使品红溶液褪色,说明二者均有较强的氧化性 |
 各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.
各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板. 在容积固定的2L密闭容器中,一定条件下发生如下反应:X(g)+2Y(g)?nZ(g),反应过程中各物质的量与时间的关系如图所示.完成下列填空:
在容积固定的2L密闭容器中,一定条件下发生如下反应:X(g)+2Y(g)?nZ(g),反应过程中各物质的量与时间的关系如图所示.完成下列填空: