题目内容
19.生活中的一些问题常涉及到化学知识,则下列叙述正确的是( )| A. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 | |
| B. | 明矾和漂白粉常用于自来水的处理,两者的作用原理相同 | |
| C. | 氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,与铜发生置换反应 | |
| D. | 晶体硅具有半导体的性质,所以可以制作光导纤维 |
分析 A、高温可使蛋白质发生变性;
B、明矾净水利用了氢氧化铝胶体的吸附性,漂白粉净水利用了次氯酸的强氧化剂;
C、氯化铁溶液与铜反应生成氯化亚铁和氯化铜;
D、单质硅可以制太阳能电池,二氧化硅制光导纤维.
解答 解:A、病菌中含有蛋白质,高温可使蛋白质发生变性,故A正确;
B、明矾净水利用了氢氧化铝胶体的吸附性,漂白粉净水利用了次氯酸的强氧化剂,原理不同,故B错误;
C、氯化铁溶液与铜反应生成氯化亚铁和氯化铜,表现了氯化铁的氧化性,故C错误;
D、晶体硅具有半导体的性质,可以制太阳能电池,二氧化硅制光导纤维,故D错误.
故选A.
点评 本题考查知识点较多,涉及蛋白质的变性、净水原理、铁离子的氧化性等知识,难度不大,注意物质的性质的应用是关键.

练习册系列答案
相关题目
9.某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol•L-1 NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母):a b e.
Ⅱ.某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀.甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数.
(1)按照甲同学的观点,发生反应的离子方程式为Cu2++2HCO3=CuCO3↓+CO2↑+H2O.
(2)两同学利用如图所示装置进行测定:

①在研究沉淀物组成前,须将沉淀从溶液中分离并净化.具体操作依次为过滤、洗涤、干燥.
②装置E中碱石灰的作用是防止空气中CO2和水蒸气进入装置D.
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是cab(填选项序号,下同).若未进行步骤b,将使测量结果偏低.
④若沉淀样品质量为m g,装置D质量增加了n g,则沉淀中CuCO3的质量分数为$\frac{31n}{11m}$.
(3)丙同学认为还可以通过测量CO2的体积或测量样品质量和样品充分灼烧后的质量来测定沉淀中CuCO3的质量分数.
Ⅰ.配制0.50mol•L-1 NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母):a b e.
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)按照甲同学的观点,发生反应的离子方程式为Cu2++2HCO3=CuCO3↓+CO2↑+H2O.
(2)两同学利用如图所示装置进行测定:

①在研究沉淀物组成前,须将沉淀从溶液中分离并净化.具体操作依次为过滤、洗涤、干燥.
②装置E中碱石灰的作用是防止空气中CO2和水蒸气进入装置D.
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是cab(填选项序号,下同).若未进行步骤b,将使测量结果偏低.
④若沉淀样品质量为m g,装置D质量增加了n g,则沉淀中CuCO3的质量分数为$\frac{31n}{11m}$.
(3)丙同学认为还可以通过测量CO2的体积或测量样品质量和样品充分灼烧后的质量来测定沉淀中CuCO3的质量分数.
10.下列有关实验的装置、试剂选用或操作正确的是( )
| A.配制0.10mol•L-1溶液 | B.除去CO中的CO2 | C.苯萃取碘水中I2,分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 |  |  | 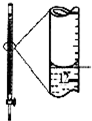 |
| A. | A | B. | B | C. | C | D. | D |
7.下列各组离子在指定溶液中,一定能大量共存的是( )
| A. | 加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,SO42- | |
| B. | 含有NaClO的溶液中:K+,Al3+,Br-,S2- | |
| C. | 澄清透明溶液:Cu2+、SO42-、HCO3-、H+ | |
| D. | 使甲基橙变红的溶液中:Fe2+,MnO4-,Na+,SO42- |
4.下列表示对应化学反应的离子方程式正确的是( )
| A. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 向FeBr2溶液中通入足量 Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| D. | 向50 mL 1 mol•L-1明矾溶液中滴入两滴0.1 mol•L-1Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
11.下列有关叙述正确的是( )
| A. | HClO的电子式为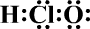 | |
| B. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| C. | CH3COOH溶液和NaCl溶液均通过离子导电,说明CH3COOH和NaCl中均含离子键 | |
| D. | Cl2、SO2均能使品红溶液褪色,说明二者均有较强的氧化性 |
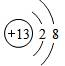 ;工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,请写出电解反应方程式2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;在电解过程中阳极(填“阴”或“阳”)需要定期补充.
;工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,请写出电解反应方程式2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;在电解过程中阳极(填“阴”或“阳”)需要定期补充.