题目内容
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+==Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是 ( )
| A.反应中硫元素被氧化,所有铁元素均被还原 |
| B.氧化剂是Fe3+,氧化产物是Cu2+ |
| C.反应中转移电子的物质的量为x mol |
| D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x) mol |
D
解析试题分析:A、CuFeS2中铁元素的化合价为+2价,反应物Fe3+的化合价为+3价,生成物中Fe2+的化合价为+2价,所以不是所有铁元素均被还原,故A错误;B、依据反应中元素化合价的变化硫元素化合价从-2变化为0价被氧化为S,氧化产物是S,还原产物是Fe2+,铜离子反应前后化合价不变,所以氧化剂是Fe3+,氧化产物是S,故B错误;C、由CuFeS2+4Fe3+=Cu2++5Fe2++2S可知,生成2molS转移电子为4mol,则获得单质硫x mol转移电子为2x mol,故C不正确;D、由CuFeS2+4Fe3+==Cu2++5Fe2++2S,生成单质硫x mol时,生成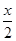 molCu2+
molCu2+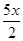 x molFe2+ 消耗2x molFe3+ ,余下(y mol-
x molFe2+ 消耗2x molFe3+ ,余下(y mol-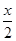 mol-
mol- 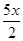 x mol)=(y-3x)molFe3+ ,则原Fe3+的总物质的量为(y-3x+2x) mol=(y-x) mol,D正确,选D。
x mol)=(y-3x)molFe3+ ,则原Fe3+的总物质的量为(y-3x+2x) mol=(y-x) mol,D正确,选D。
考点:氧化还原反应;氧化还原反应的计算

在100m L含等物质的量的HBr和H2SO3的溶液里通入0.025molCl2,有一半Br-变为Br2(已知Br2能氧化H2SO3 )。则原溶液中HBr和H2SO3的浓度都等于( )
| A.0.25mol·L-1 | B.0.002mol·L-1 | C.0.02mol·L-1 | D.0.2mol·L-1 |
某氧化剂中,起氧化作用的是X2O72-离子,在溶液中0.2mol该离子恰好能使0.6mol的SO32-离子完全氧化,则X2O72-离子还原后X的化合价为
| A.+1 | B.+2 | C.+4 | D.+3 |
实验室可以用高锰酸钾与浓盐酸反应制取氯气,反应的化学方程式如下:
2KMn04+16HCl(浓) = 2KCl+5Cl2↑+2MnCl2+8H20
对于该反应,下列说法正确的是
| A.HCl是氧化剂 | B.是非氧化还原反应 |
| C.反应中锰元素被还原 | D.反应中氢元素的化合价升高 |
将0.195g锌粉加入到20mL 0.100 mol?L—1MO2+溶液中,恰好完全反应,则还原产物可能是
| A.M | B.M2+ | C.M3+ | D.MO2+ |
我国的新(饮用天然矿泉水国家标准)规定了饮用水中可能致癌物溴酸盐的限值:0.01mg/L,日前很多饮用水企业都采用臭氧消毒法进行水的消毒,这个过程可能生成溴酸盐。原因是水中的Br-被臭氧氧化为BrO2-,其过程示意为:Br-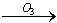 BrO-
BrO-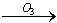 BrO2-
BrO2-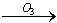 BrO3-,下列有关说法正确的是
BrO3-,下列有关说法正确的是
| A.臭氧消毒法和明矾净水原理相同,都是利用胶体吸附原理 |
| B.若改用氧气消毒,可避免生成溴酸盐 |
| C.BrO- 3氧化性比O3强 |
| D.生成溴酸盐的过程是给水消毒的副反应,需控制条件减少BrO3-的产生 |
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )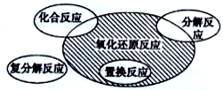
| A.Cl2+2KBr=Br2+2KCl |
B.2NaHCO3  Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Na2O2+2CO2=2Na2CO3+O2 |
已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是
| A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ |
| B.a点时消耗NaHSO3的物质的量为0.12mol |
| C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol |
| D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2 |