题目内容
将0.195g锌粉加入到20mL 0.100 mol?L—1MO2+溶液中,恰好完全反应,则还原产物可能是
| A.M | B.M2+ | C.M3+ | D.MO2+ |
B
解析试题分析:n(Zn)=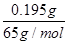 =0.003mol,
=0.003mol,
n(MO2+)=0.02L×0.100mol·L-1=0.002mol,
设反应后M的化合价为+x价,
则(5-x)×0.002mol=0.003mol×(2-0),x=2,
故选B.
考点:氧化还原反应的计算

练习册系列答案
相关题目
根据表中信息判断,下列选项不正确的是
| 序列 | 参加反应的物质 | 生成物 |
| ① | KMnO4 、H2O2 、H2SO4 | K2SO4 、MnSO4…… |
| ② | Cl2 、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- …… | Cl2 、Mn2+ …… |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2
同位素示踪法可用于反应机理的研究,下列有关反应中同位素示踪表示正确的是
| A.2Na218O2 + 2H2O=4Nal8OH + O2↑ |
| B.2KMnO4 + 5H218O2 + 3H2SO4=K2SO4 + 2MnSO4 + 518O2↑ + 8H2O |
C.NH4Cl + 2H2O NH3·2H2O + HCl NH3·2H2O + HCl |
| D.K37ClO3 + 6HCl=K37Cl + 3Cl2↑ + 3H2O |
下列变化过程中,属于还原反应的是
| A.HCl→Cl2 | B.Na→Na+ | C.CO→CO2 | D.Fe3+→Fe |
为了实现下列各变化,需加入还原剂的是
| A.KClO3→O2 | B.NH4+→NH3 | C.Fe→FeCl3 | D.CO2→CO |
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+==Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是 ( )
| A.反应中硫元素被氧化,所有铁元素均被还原 |
| B.氧化剂是Fe3+,氧化产物是Cu2+ |
| C.反应中转移电子的物质的量为x mol |
| D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x) mol |
下列反应中,水作为氧化剂的是
| A.SO2与H2O反应 | B.Al与NaOH溶液反应 |
| C.NO2与H2O反应 | D.Na2O2与H2O反应 |
氢化铝钠(NaAlH4)是最冇研究应用前景的络合金属氢化物,氢化铝钠储放氢时发生反应:3NaAlH4 Na3AlH6+2Al+3H2↑。下列说法正确的是
Na3AlH6+2Al+3H2↑。下列说法正确的是
| A.NaAlH4中氢元素为+1价 |
| B.每生成11. 2 L(标准状况下)H2,转移2NA个电子 |
| C.在反应中有50%的氢被氧化 |
| D.反应中氧化产物与还原产物的物质的量之比为1: 1 |
三氟化氮(NF3)是一种无色无味的气体,它是氨和氟(F2)在一定条件下直接反应得到:4NH3+3F2=NF3+3NH4F,下列有关NF3的叙述正确的是( )
| A.NF3的氧化性比F2强 |
| B.NF3的还原性比NH3强 |
| C.NF3中的原子最外层均达8电子 |
| D.该反应过程转移了6 mol电子。 |