题目内容
在100m L含等物质的量的HBr和H2SO3的溶液里通入0.025molCl2,有一半Br-变为Br2(已知Br2能氧化H2SO3 )。则原溶液中HBr和H2SO3的浓度都等于( )
| A.0.25mol·L-1 | B.0.002mol·L-1 | C.0.02mol·L-1 | D.0.2mol·L-1 |
D
解析试题分析:因为Br2能氧化H2SO3,所以H2SO3还原性较强。Cl2应先氧化H2SO3再氧化HBr。设等物质的量的HBr和H2SO3的物质的量为。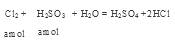 ,充分反应后余下的氯气再和HBr反应。
,充分反应后余下的氯气再和HBr反应。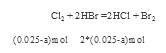 因为有一半Br-变为Br2,所以2*(0.025-a)mol=a/2 。所以可以求出a=0.002mol。可以求解:
因为有一半Br-变为Br2,所以2*(0.025-a)mol=a/2 。所以可以求出a=0.002mol。可以求解:
考点:要求学生掌握氧化还原反应中的谁强谁先的规律。经常性考察SO32->I->Fe2+>Br->Cl-这些离子的还原性的大小顺序。

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
下列变化需加入还原剂才能完成的是
| A.MnO2→MnO4- | B.CO2→HCO3- | C.HS-→S2- | D.NO3-→NO |
下列应用涉及氧化还原反应的是
| A.粗盐提纯 | B.人工固氮 | C.工业制氧 | D.玻璃刻字 |
M2O7x- 和S 2- 离子在酸性溶液中发生如下反应:M2O7x- +3S2-+14H+ =2M3+ +3S↓+7H2O,
则M2O7x- 离子中M元素的化合价是( )
| A.+2 | B.+3 | C.+4 | D.+6 |
根据表中信息判断,下列选项不正确的是
| 序列 | 参加反应的物质 | 生成物 |
| ① | KMnO4 、H2O2 、H2SO4 | K2SO4 、MnSO4…… |
| ② | Cl2 、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- …… | Cl2 、Mn2+ …… |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2
反应:Cr2O72—+3SO32—+aH+=2Cr3++3Y+4H2O下列说法不正确的是
| A.Y是SO42— |
| B.a=8 |
| C.Cr2O72—被氧化成Cr3+ |
| D.生成1mol Cr3+时转移的电子数是3×6. 02×1023 |
下列类型的反应,一定不属于氧化还原反应的是( )
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
已知在酸性条件下能发生下列反应:Cu+→Cu+Cu2+(未配平)。NH4CuSO3与足量的2mol/L硫酸溶液混合微热,产生下列现象:①有紫红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法一定合理的是
| A.该反应显示硫酸具有酸性 | B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 | D.反应中硫酸作氧化剂 |
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+==Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是 ( )
| A.反应中硫元素被氧化,所有铁元素均被还原 |
| B.氧化剂是Fe3+,氧化产物是Cu2+ |
| C.反应中转移电子的物质的量为x mol |
| D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x) mol |