题目内容
置换反应的通式可以表示为:
单质(1)+化合物(1)= 单质(2)+化合物(2)
请联系所学过的单质 (如H2、C、Si、Cl2、Br2、I2、Na、Mg、Al、Cu、Fe等)的性质,写出满足以下条件的化学方程式(各写一个)。
(1)单质(1)和单质(2)都是金属: ;
(2)单质(1)是金属,而单质(2)是非金属: ;
(3)单质(1)是非金属,而单质(2)是金属: ;
(4)单质(1)和单质(2)都是非金属: 。
(1)Fe+CuCl2="Cu" + FeCl2或铝热反应等
(2)Fe+2HCl=FeCl2+H2↑或金属钠与水反应、金属镁与二氧化碳反应等
(3)H2+CuO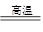 Cu+H2O 或碳还原氧化铜、氢气还原氧化铁等
Cu+H2O 或碳还原氧化铜、氢气还原氧化铁等
(4)Cl2+2NaBr=Br2+2NaCl等
解析试题分析:常见的置换反应有:(1)金属置换金属:如溶液中金属与盐的反应、铝热反应;(2)非金属置换非金属:卤素间的置换、氟气与水的反应、二氧化硅与碳的反应、硫化氢与氯气反应;(3)金属置换非金属:活泼金属与非氧化性酸的反应、钠与水的反应、镁在二氧化碳中燃烧、锌与硫酸氢钠溶液的反应;(4)非金属置换金属:氢气与氧化铜的反应、碳与氧化铁反应。
考点:常见金属、非金属的化学性质 置换反应

已知在酸性条件下能发生下列反应:Cu+→Cu+Cu2+(未配平)。NH4CuSO3与足量的2mol/L硫酸溶液混合微热,产生下列现象:①有紫红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法一定合理的是
| A.该反应显示硫酸具有酸性 | B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 | D.反应中硫酸作氧化剂 |
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+==Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是 ( )
| A.反应中硫元素被氧化,所有铁元素均被还原 |
| B.氧化剂是Fe3+,氧化产物是Cu2+ |
| C.反应中转移电子的物质的量为x mol |
| D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x) mol |
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学方程式为: 5KClO3 + 6P=3P2O5 + 5KCl ,则下列有关叙述错误的是 ( )
| A.上述反应属于氧化还原反应 |
| B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾) |
| C.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替 |
| D.上述反应中消耗3molP时,转移电子的物质的量为15mol |
氢化铝钠(NaAlH4)是最冇研究应用前景的络合金属氢化物,氢化铝钠储放氢时发生反应:3NaAlH4 Na3AlH6+2Al+3H2↑。下列说法正确的是
Na3AlH6+2Al+3H2↑。下列说法正确的是
| A.NaAlH4中氢元素为+1价 |
| B.每生成11. 2 L(标准状况下)H2,转移2NA个电子 |
| C.在反应中有50%的氢被氧化 |
| D.反应中氧化产物与还原产物的物质的量之比为1: 1 |
在真空密闭装置中,亚氯酸钠(NaClO2)固体在一定条件下发生分解反应,不可能形成的产物是
| A.NaCl和O2 | B.NaClO3和NaClO | C.NaClO3和Cl2 | D.NaClO3和NaCl |
在Cu2S+2Cu2O 6Cu+SO2↑反应中,说法正确的是
6Cu+SO2↑反应中,说法正确的是
| A.Cu2O在反应中被氧化 | B.Cu2S在反应中既是氧化剂又是还原剂 |
| C.Cu既是氧化产物又是还原产物 | D.若反应中转移12mol电子,则生成6molCu |
钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有CO、Pd、H2O、HCl、PdCl2和一种未知物质X。下列说法错误的是
| A.未知物质X为CO2,属于氧化产物 |
| B.每转移1mol e-时,生成2mol X |
| C.反应中PdCl2作氧化剂,被还原 |
| D.还原性:CO>Pd |